摘要
杨桃是一种食用水果,广泛种植于中国南部、东南亚、印度和南美洲北部。它味道香甜多汁,常用于水果沙拉和水果拼盘中,作为鸡尾酒饮料和饮料中的装饰,或榨成果汁作为饮料。传统上,数千年来它一直用于治疗糖尿病和高血压、关节痛、呕吐、结石尿、咳嗽、宿醉和慢性阵发性头痛。目前,已从杨桃中分离出约132 种化合物。其中,黄酮类、苯醌及其苷类被认为是生物活性物质,负责多种生物活性。药理研究表明,杨桃粗提物或单体化合物具有多种生物活性,如抗氧化、降血糖、抗肥胖、降血压、抗肿瘤、抗炎、保肝、保护心脏、抗心律失常等。因此,杨桃是一种有价值的中医治疗药物,具有治疗多种疾病的潜力,特别是糖尿病和高血压相关疾病。本文对杨桃的植物学、民族药理学、植物化学、药理学及毒性等方面的研究进展进行了全面、系统的综述,为杨桃在医药工业和功能食品中的进一步开发和应用提供了有价值的参考。
关键词:杨桃,化学成分,抗糖尿病,抗癌,毒理学,降血压
1.引言
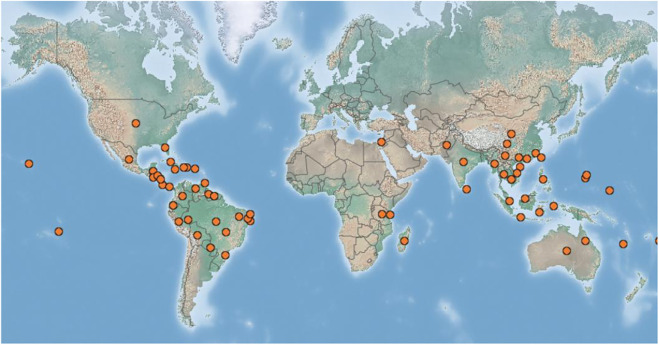
杨桃(Averroa carambola L.),俗称阳桃,是酢浆草科杨桃属的多年生乔木。(图1)。它被认为原产于马来西亚,然而,它是一种热带美洲物种,由西班牙大帆船引入亚洲,主要种植在热带和温暖的亚热带地区(图2)。该果实具有很高的商业价值,在中国南方、东南亚、印度和南美洲北部有特殊而广泛的分布和栽培( Saikia et al., 2015 ; Leivas et al., 2016b ; Varela-Martínez et al., 2019;Zulfajri 等人,2019)。杨桃肉质肥厚、松脆、多汁、微酸、酸甜。外观呈星形,呈金黄色,常用于制作水果沙拉和水果拼盘,作为鸡尾酒和饮料中的装饰,或榨成果汁作为功能性饮料。由于其高水分含量和极易腐烂,它还用于果冻、冰淇淋、蜜饯和糖果,特别是在马来西亚、新加坡和印度尼西亚等热带地区(Valim 等人,2016 年;Chua 等人,2017 年);Huynh 和 Nguyen,2017;Jia 等人,2018;Lu 等人,2018)。例如,在马来西亚,杨桃通常与苹果混合,与丁香和糖一起炖,或者与肉类或海鲜一起烹调(Bhat 等,2011)。

一般来说,杨桃被认为是矿物质、蛋白质、维生素等多种营养素的丰富来源,还富含黄酮类、萜类、皂苷类、生物碱、原花青素、维生素C、酒石酸、草酸、α -酮戊二酸、柠檬酸、维生素 B 1和 B 2、胡萝卜素、果胶、纤维素、没食子酸、表儿茶素、脂肪酸、挥发性香料、纤维、半纤维素、多糖和甾醇(Shui 和 Leong,2006 年)。同时GC-MS分析表明,杨桃叶中富含的脂肪酸为α-亚麻酸(62.04%)和果实中的油酸(55.44%)。而且,杨桃果实和叶子中存在的总不饱和脂肪酸比例占总脂肪酸的77%以上( Wei等,2014 )。杨桃成熟果实中的果糖含量(38-48%)和葡萄糖含量(21-25%)主要是糖基成分,而山梨醇也是成熟果实中另一种主要的糖醇(2.4-10.5%)。此外,这种植物中存在大量纤维有助于葡萄糖的吸收,抑制葡萄糖扩散到血液中,并维持正常的血糖水平(Fan et al., 2020)。此外,果汁饮料提取后留下的杨桃副产品或果渣残留物比提取的果汁含有更多的抗氧化剂(Shui 和 Leong,2006)。有趣的是,加入 4%杨桃果汁和 6%禾本科竹笋提取物,可显着延长猪肉块的保质期至少 2 周(Thomas et al., 2016)。最近的研究发现,纯化的抗冻蛋白和协同果胶-麦芽糖糊精-氯化钠可食用涂层可以显着提高冷冻杨桃的质量(Provesi et al., 2019)。
近年来,植物化学研究表明,杨桃的主要化学成分主要包括黄酮类、萜类和其他酚类物质。其中,2-十二烷基-6-甲氧基环己-2,5-二烯-1,4-二酮(122,DMDD)是最具代表性的化合物,具有多种生物活性(Gao et al., 2015;Xie et al., 2016;陈等人,2017b)。药理研究表明,杨桃的粗提物或活性物质具有多种促进健康的作用,并且上述许多生物效应具有民族药用价值。此外,杨桃的使用范围日益从药用植物扩展到花园中的观赏植物。例如,杨桃因其美丽的外观而被广泛种植在中国南方城市的街道上作为装饰树(Wu et al., 2020b)。更重要的是,据报道,中国每年杨桃的总消费量约为260万吨,而杨桃的年产量仅为200万吨(Wu等,2020b)。
迄今为止,还没有权威发表的系统且全面的综述来关注杨桃的所有重要方面。本文全面介绍并严格评价了杨桃的传统用途、植物学特征、分布、分类、植物化学成分、生物效应以及毒性方面的最新进展。此外,还很好地总结了与该植物粗提物或成分的生物活性相关的潜在机制。该综述有助于研究人员全面了解这种日益重要的草药,并为今后进一步研究和开发杨桃药用制剂或功能食品提供科学依据。
2.材料与方法
本文对杨桃的植物学描述、传统用途、化学成分、药理活性和毒性等方面的文献进行了收集、分析、总结。所有信息均系统地收集自全球公认的互联网数据库科学数据库,包括 Elsevier、ScienceDirect、PubMed、Web of Science、Wiley、Springer、SciFinder、ACS Publications、CNKI、万方、Google Scholar、百度学术、The Plant List Database 和其他文献来源(博士和硕士学位论文)。所有以不同语言发表的关于杨桃的文章均被纳入并引用。馆藏作品的鉴定和审查以标题和摘要为依据。还检查了检索到的出版物的参考文献列表,以确定进一步的相关论文。所有分离化合物的化学结构均使用ChemBioDraw Ultra 14.0软件绘制。
3.植物学描述、地理分布和分类学
3.1植物描述
从植物学角度来看,杨桃是一种中等大小的乔木,高达 3-15 m。茎是灰色的树皮。叶为奇数复叶,互生,小叶5-13枚,全缘,卵形或椭圆形,长3-7厘米,先端渐尖,基部圆形,一侧偏斜,下面疏被柔毛或无毛。花为聚伞花序或圆锥花序;萼片5,长约5毫米,呈覆瓦状排列,基部合成环;花瓣稍背侧,长0.8-1厘米,紫红色,有时背面粉红色或白色;雄蕊5-10;子房5室,每室多数胚珠,花柱5。果实肉质,下垂,有5棱,很少有6或3棱,断面呈星形,长5~8厘米,淡绿色或蜡黄色,有时深红。种子黑褐色(中国植物志编委会,1998)。
3.2地理分布
传统上认为杨桃起源于马来西亚,但也有人推测它是由西班牙帆船引入亚洲的热带美洲物种。杨桃的气候范围较广,可在北纬32°至南纬30°范围内生长,既能在炎热潮湿的热带地区生长,又能在埃及、以色列等亚热带国家生长,能耐受短期低温至低温为-3°C。它更喜欢排水良好的土壤,理想的 pH 值在 5.5-6.5 之间,但可以容忍 pH 值在 5 到 8.5 之间(Bircher 和 Bircher,2000)。近年来在世界大部分地区广泛分布和广泛栽培(图2),例如中国、印度等亚洲国家,马达加斯加、坦桑尼亚等非洲国家,墨西哥、洪都拉斯等北美国家,澳大利亚、法属波利尼西亚等大洋洲国家,巴西、玻利维亚等南美洲国家等。
3.3分类
杨桃属于酢浆草科,由酢浆草属、酢浆草属、肉室属、艾希勒属、Biophytum、Hypseocharis 和 Averroa 等 7 属 900 多个物种组成。其中,阳桃属主要包括3个种,即A. carambola、 A . bilimbi L.、A. dolichocarpa Ruhayah和Sunart(Moresco et al. ,2012)。重要的是,杨桃通常被称为阳桃或星果,结出深脊状、黄棕色的可食用果实。
4.传统用途
数千年来,杨桃一直被用于治疗糖尿病和高血压、关节痛、呕吐、尿路结石、咳嗽和宿醉以及慢性阵发性头痛。杨桃的不同药用器官,包括叶、根、花和果实,长期以来在中国、印度、马来西亚和巴西医学中被用作民族药物。例如,马来西亚传统医学常用杨桃的嫩芽或叶子来治疗头痛、水痘和癣,而杨桃的叶子和果实的汤剂通常用于治疗呕吐、发烧、口疮性口炎和心绞痛(Yang et al., 2020b)。在斯里兰卡,杨桃果实传统上用于治疗和预防糖尿病,因为其具有优异的降血糖作用(Abeysekera 等,2015)。在巴西传统医学中,杨桃的果实、果汁以及叶制成的茶传统上被用来预防和治疗糖尿病、高血压和泌尿系统疾病,杨桃也被认为是一种食品补充剂可以改善食欲不佳者的食欲(Vasconcelos 等,2006;Soncini 等,2011)。印度传统医学记载,杨桃的果实可有效治疗高血压,也被视为治疗湿疹、发烧、腹泻的良药。此外,杨桃的成熟果实在阿育吠陀中主要被认为是消化剂和补品(Vasant 和 Narasimhacharya,2014)。作为传统中药,杨桃的根、果、叶越来越被认为是补肾壮阳的有效草药,并且被广泛认为是补肾壮阳的有效草药。用于治疗各种疾病已有悠久的历史(世界卫生组织和西太平洋区域办事处,2007;Wei等人,2018)。更具体地说,杨桃的根已被普遍认为是一种利尿剂和食欲兴奋剂,它也被用作具有悠久历史的止泻和退热药物,在中医中用于治疗关节痛、糖尿病、高血压、尿路结石,古代慢性阵发性头痛( Cabrini等,2011;Wen等,2013;郑等人,2013;陈等人,2017b)。同时,杨桃叶多年来常被用于缓解呕吐、头痛、糖尿病、咳嗽和降血压(Carolino 等,2005;Ferreira 等,2008)。此外,杨桃果实经常被用来有效治疗疟疾脾肿大和肉类来源引起的食物中毒(Pang等,2017)。总的来说,这种植物的叶、根、花和果实可以用作膳食补充剂,并且应该进一步研究和开发作为人类健康管理中的功能性食品或治疗剂。
5.营养和植物化学成分
5.1营养成份
杨桃的果实中含有矿物质、维生素、纤维素、半纤维素、果胶等营养物质。据报道,杨桃含有纤维素(60%)、半纤维素(27%)和果胶(13%),可能有助于控制血糖水平(Lakmal et al., 2021)。此外,杨桃成熟果实中还含有胡萝卜素、维生素和酸,其中维生素C(25.8毫克/100克果)、酒石酸(4.37毫克/100克果)、维生素B1和B2( 0.12 毫克/100 克水果)(Muthu 等人,2016)。此外,阳桃中还含有大量矿物质元素,其中钾(167.13-168.0毫克/100克果)、磷(17.87-17.88毫克/100克果)、镁(11.85-12.05毫克/100克果)含量较高。 100 克水果)、钙(6.37–6.40 毫克/100 克水果)、钠(3.8–3.85 毫克/100 克水果)、铁(0.34–0.45 毫克/100 克水果)、锌(0.29–0.51 毫克/100 克水果)水果)、铜(0.19–0.45 毫克/100 克水果)和锰(0.04–0.52 毫克/100 克水果)(Muthu 等人,2016 年)。这些结果表明杨桃热量低,还可能具有促进健康的特性。
5.2植物化学化合物
目前,已从杨桃中分离鉴定出约132种植物化学成分,其中含有黄酮类、萜类、苯丙素类及其苷类等。其中包括类黄酮、苯醌及其苷类,它们被认为是具有多种生物活性的生物活性成分。从杨桃中分离出的化合物已记录并列出在表格1化学结构被绘制并呈现在图3。


黄酮类化合物各种研究发现,从这种植物中分离出的黄酮类化合物具有优异的抗氧化和自由基清除特性,可用于预防和治疗慢性疾病和心血管疾病的发生(Maqsood et al., 2020)。到目前为止,已经通过核磁共振 (NMR) 和质谱 (MS) 技术从杨桃的叶、果实和根中分离和表征了51 种黄酮类化合物(1–51)。其中化合物(1-27)是二氢查耳酮 C-糖苷,其他化合物(28-35)是黄烷-3-醇,其中所有化合物都对 DPPH 和 ABTS 表现出显着的自由基清除活性,而一些化合物(36- 51)是具有多种结构的其他类型。化合物杨桃黄酮 A (47)和杨桃黄酮 B (48)在高血糖和糖尿病大鼠模型中均表现出优异的抗高血糖活性(Cazarolli 等,2009;Cazarolli 等,2012)。随后,王等人。 (2018)对杨桃黄酮A (47)的对映体进行了全合成,发现结构上β-岩藻糖基部分的绝对构型是D而不是L。这些分离的黄酮类化合物的信息列于表格1。它们的化学结构由 ChemBioDraw Ultra 14.0 绘制并描述于图3。
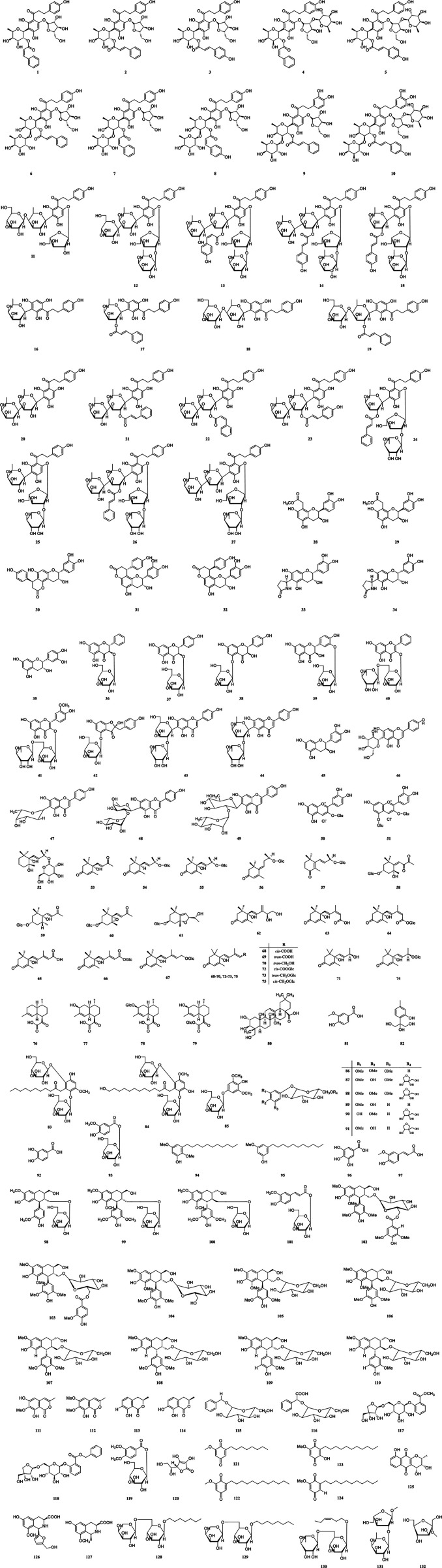
萜烯是植物中的一组次生代谢物,由一个或多个异戊二烯亚基组成(Bahramsoltani 等,2020)。它们具有促进多种蔬菜和水果着色的功能(Farias et al., 2020)。迄今为止,已从杨桃鲜果中主要分离鉴定出29种萜类化合物(52-80)。古纳瓦德纳等人2015年利用NMR和MS方法分析了杨桃中的不同萜类化合物,鉴定出的主要萜类化合物是顺式脱落酸( 68,12mg )、反式脱落酸( 69,3.5mg )、反式脱落醇( 70, 12 mg)、(6S,9R)-vomifoliol ( 71 , 8.5 mg)、顺式-脱落酸 β-D-吡喃葡萄糖酯 ( 72 , 19 mg)、反式-脱落醇 β-D-吡喃葡萄糖苷 ( 73 , 12 mg) 、(6S,9R)-玫瑰苷(74、12毫克)和顺式脱落醇 β-D-吡喃葡萄糖苷(75、113毫克)。此外,发现杨桃中的萜烯衍生成分主要是 C 13 – 和 C 15 -降异戊二烯类化合物,它们极大地增强了杨桃果实的风味。这些萜烯的信息列于表格1。化学结构由ChemBioDraw Ultra 14.0绘制并显示在图3。然而,大多数萜烯的药理活性仍不清楚。
酚醛树脂酚类化合物是植物次生代谢产物的主要类别之一,广泛分布于植物各部位,植物化学研究发现这些化合物主要存在于杨桃的根和果实中( Wen et al., 2012;Yang et al. ., 2014 ; Jia et al., 2017 ; Liao et al., 2019a ).目前,从杨桃的根和果实中分离得到16种酚类成分(81-96) ,并通过FT-IR、 1 H-NMR和13 C-NMR表征,具有优异的抗氧化性能。其中,化合物83、84、94、95在结构上为烷基酚。研究人员比较了原产于中国南方的四个杨桃品种的酚类和黄酮类化合物含量,发现四个品种的结合酚、游离酚和总酚含量分别为6.4~19.7、162.5~286.8和174.5每 100 克鲜重分别含有 293.1 毫克没食子酸当量。 4个品种的结合黄酮、游离黄酮和总黄酮含量分别为每100 g鲜重1.1~7.8、100.7~234.0和104.4~235.1 mg儿茶素当量,表明其中含有一定量的非黄酮酚类物质存在。这些酚类组合物总结于表中。它们的化学结构由 ChemBioDraw Ultra 14.0 绘制,并显示在图3。
苯丙素类苯丙素是一种源自植物的有机化合物,这些化合物主要来源于苯丙氨酸和酪氨酸( Yao et al., 2020 )。目前,通过分析1 H-NMR和13 C-NMR等光谱数据,已从杨桃的果实和根中成功分离和化学鉴定了18种苯丙素(97-114)。这些化合物根据其子结构类型可分为简单苯丙素、木脂素和香豆素。其中,杨桃果实中报道了四种简单的苯丙素(97-101),十二种木脂素(102-110)主要是从杨桃根中获得和鉴定的。此外,在杨桃果实中还发现了四种香豆素(111-114),化合物网状果醇(111)和 6-O-甲基-网状果醇(112)在结构上是异香豆素,5-甲基梅林(113)和 7-羟基- 5-甲基蜜肽(114)在结构上是二氢异香豆素。 Reticulol (111)对 DPPH 显示出中等的抗氧化能力,IC 50值为 58 μg/ml ( Sritharan et al., 2019 )。这些苯丙素成分总结在表格1相应的化学结构也由ChemBioDraw Ultra 14.0绘制并呈现在图3。
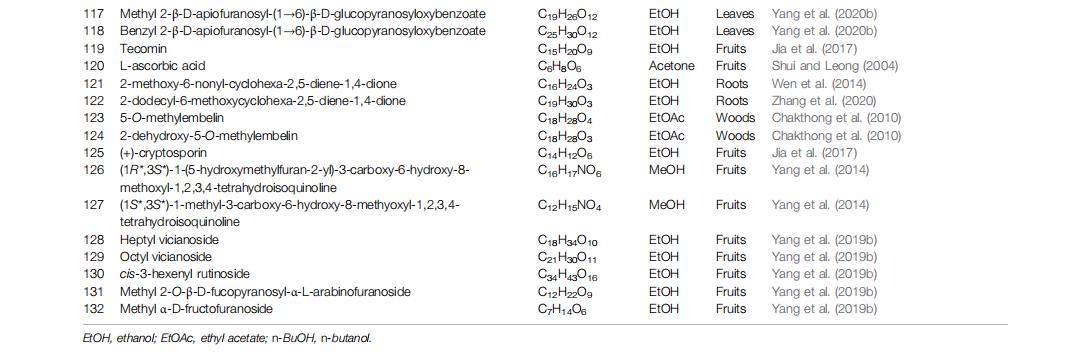
其他化合物迄今为止,除了上面列出的化合物外,很少有化合物(115-132)被研究并总结在表格1并给出了相应的化学结构图3。简而言之,化合物117和118被鉴定为苯甲酸,化合物121-125为醌,化合物126和127为四氢异喹啉生物碱,并且组分128-132被鉴定为烷基糖苷。其中,2-dodecyl-6-methoxycyclohexa-2,5-diene-1,4-dione (122)是从杨桃根中获得并表征的,在细胞和动物实验研究中显示出多种生物活性,包括抗癌(高等,2015;陈等,2017b )、抗糖尿病肾病(卢等,2019 )、抗肥胖(李等,2016 )、抗高血压(张等, 2020)、抗炎(Xie等,2016)和神经保护活性(Wei等,2018)。
6.药理活性
6.1抗氧化活性
在具有药理活性的物质中,天然抗氧化剂因其安全、低毒性和具有前景的生物功能而备受关注(Rufino等人,2011)。杨桃在DPPH、FRAP和TEAC试验中显示出最强的抗氧化活性(表2)。植物化学研究显示,这些杨桃富含与抗氧化效应密切相关的酚类和黄酮类成分,表明杨桃可能是天然抗氧化剂的丰富来源,有助于预防和治疗与氧化应激相关的疾病(Chen等人,2017a)。Silva和Sirasa(2018)对斯里兰卡当地种植的二十种水果进行了系统比较,根据FRAP和DPPH活性、总黄酮含量、总酚含量和维生素C含量的测定结果,显示杨桃具有第三强的抗氧化性能。Siddika等人(2020)发现杨桃甲醇提取物(MEACL,在50–375 μg/ml浓度下)在针对DPPH和ABTS+的试验中表现出剂量依赖的中等强度抗氧化活性,IC50值分别为62.0和6.0 μg/ml。其他植物化学研究显示杨桃富含酚类,这可能是其清除自由基活性的动力。一项研究利用纸喷雾电离(PSI)技术与高分辨率质谱联用,揭示了从杨桃乙醇提取物(EEBAC)中分离出的生物活性化合物norathyriol具有抗氧化性质。EEBAC在1.0、3.0、10、30和100 μg/ml浓度下,通过抑制α-葡萄糖苷酶、弹性蛋白酶、ABTS+、DPPH和酪氨酸酶的活性,表现出浓度依赖的抗氧化特性,相应的IC50值分别为7.15、20.34、26.29、55.55和56.46 μg/ml(Islam等人,2020)。化合物(40)在2.5、5和10 μg/ml浓度下,对DPPH和ABTS+表现出强大的抗氧化效果,相应的IC50值分别为4.9和9.63 μg/ml(Islam等人,2020)。杨桃粗提物或生物活性成分的有效性和效力表明,它在制药和功能性食品工业中是一种有前景的抗氧化剂。
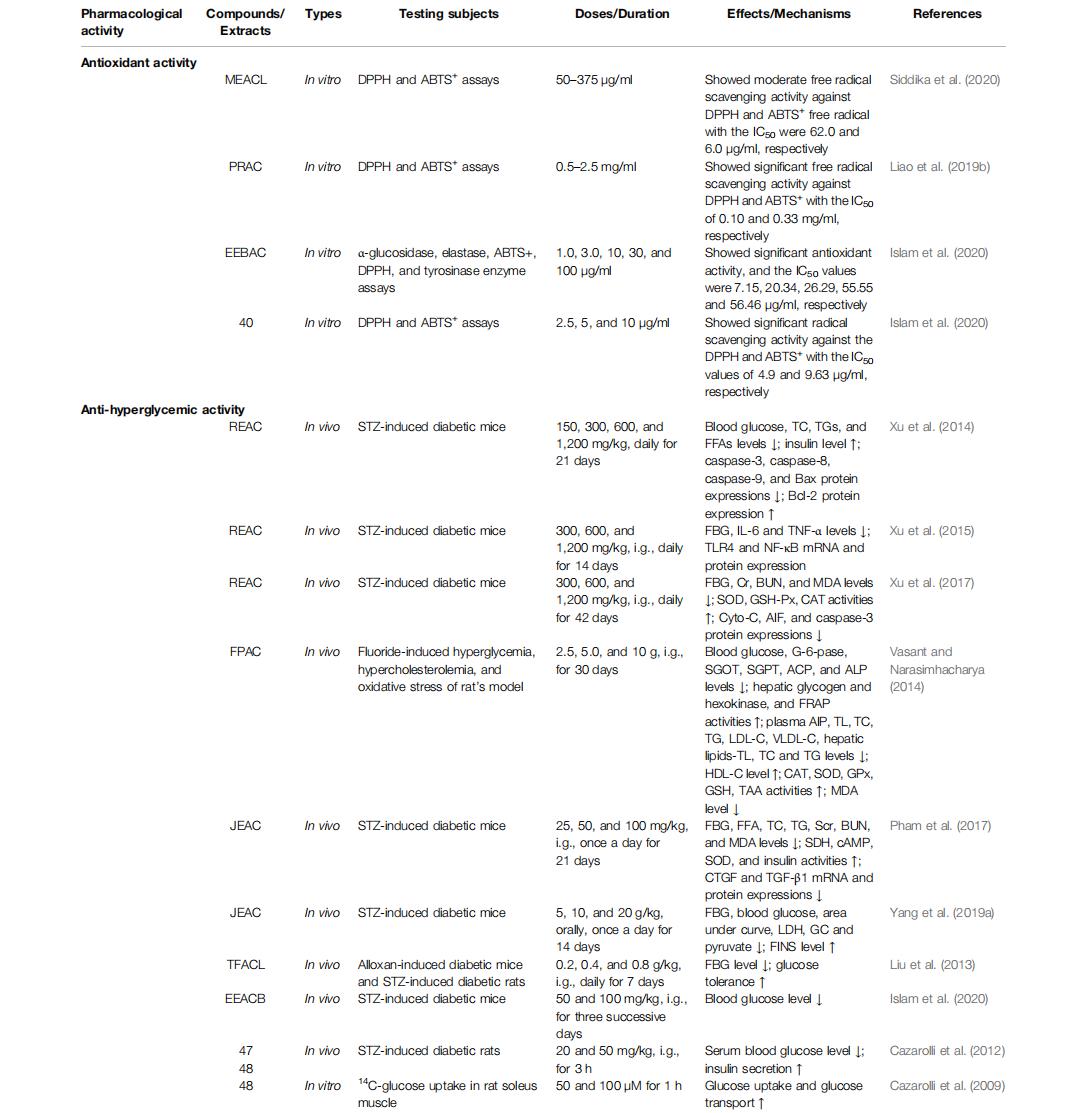
6.2抗高血糖活性
糖尿病的特征是慢性高血糖状况,可能由胰岛素缺乏、胰岛素信号传导损伤或非自身免疫病因引起,或由胰岛素敏感性显着降低引起( Teng et al., 2018 )。这种疾病造成了重大的公共医疗保健问题,其患病率在全球范围内持续上升(Chen 等人,2019)。尤其是 2 型糖尿病,其主要特征是胰岛素抵抗和 β 细胞功能障碍,从而导致胰岛素分泌减少(Uuh-Narváez 等,2021)。糖尿病患者如果患上糖尿病肾病,可能会死亡。
在过去的 5 年中,多项研究利用各种实验模型广泛探索了杨桃的抗糖尿病潜力。研究结果表明,杨桃及其苷类表现出出色的抗糖尿病特性,并且还提供了对其潜在机制的见解,尽管它们尚未完全了解。杨桃粗提物或生物活性物质的抗高血糖活性的基本机制见表2和图4。
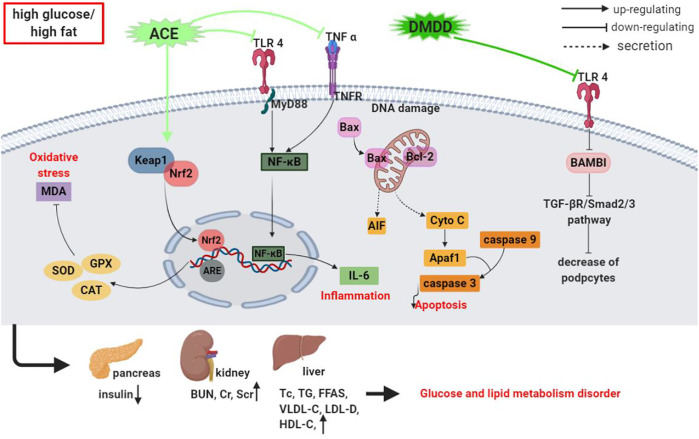
粗提物杨桃粗提物对大鼠和小鼠的降血糖活性的评估已取得令人鼓舞的结果。在一项此类评估中,患有 STZ 诱导糖尿病的小鼠口服杨桃根提取物(REAC,每日剂量为 150、300、600 和 1,200 mg/kg,持续 21 天)后,血糖、TC、TG、和 FFA 水平以及血清中胰岛素含量升高。从机械角度来看,REAC 显着下调促凋亡 caspase-3/8/9 和 Bax 蛋白表达,并上调抗凋亡 Bcl-2 蛋白表达。此外,REAC 还可防止这些小鼠的胰腺 β 细胞凋亡(Xu 等人,2014)。该研究结果表明,REAC 具有显着的降血糖能力,可以改善代谢功能并抑制胰腺 β 细胞的凋亡。
REAC 在 STZ 诱导的糖尿病小鼠中调节 TLR4/NF-κB 信号通路的抗高血糖活性研究表明,REAC(每日剂量 300、600 和 1,200 mg/kg,ig 14 天)降低了血清中空腹血糖(FBG)、TNF-α和IL-6的含量显着降低,并下调胰腺组织中TLR4和NF-κB蛋白和mRNA的表达(Xu等,2015)。Xu 等人在评估 REAC 对 STZ 刺激的糖尿病小鼠肾功能损伤的保护作用时。 (2017)发现 REAC 治疗显着降低了血清中的 FBG、血尿素氮 (BUN) 和肌酐水平,显着增强了 SOD、GSH-Px 和 CAT 活性,并降低了 MDA 水平以及 Cyto-C、AIF 和 caspase- 3.小鼠肾组织中蛋白的表达情况。
大鼠口服杨桃果粉(FPAC,每日剂量 2.5、5.0 和 10 g,持续 30 天)治疗氟化物引起的高血糖、高胆固醇血症和氧化应激后,血浆葡萄糖水平和 G-6- pase、SGOT、SGPT、ACP和ALP活性显着降低,而肝糖原、己糖激酶和FPAC活性呈剂量依赖性增加。血浆致动脉粥样硬化指数 (AIP)、总脂质 (TL)、血浆中 TC、TG、LDL-C 和 VLDL-C,肝脏中 TL、TC 和 TG 的增加以及 HDL-C 的降低颠倒了。此外,FPAC还促使大鼠肝和肾组织中CAT、SOD、GSH-Px、GSH和总抗坏血酸(TAA)活性显着增加,MDA含量下降(Vasant和Narasimhacharya,2014)。
STZ 诱导的糖尿病小鼠接受杨桃汁提取物( JEAC) 灌胃(每日剂量 25、50 和 100 mg/kg,持续 21 天)显示 FBG、FFA、MDA、TC、TG、血清肌酐显着降低(Scr) 和 BUN 水平,并显着增加胰岛素、山梨醇脱氢酶 (SDH)、cAMP 和 SOD 活性。在同一项研究中,糖尿病引起的肾组织变化,包括增厚和肾小管基底膜以及肾小球肥大,在JEAC后得到极大改善,并且肾组织中相关mRNA和蛋白(例如CTGF和TGF-β1)的表达显着降低治疗(Pham 等人,2017)。 JEAC(每日剂量为 5、10 和 20 g/kg,ig 14 天)也被证明可以显着降低血清中的 FBG 水平、血糖、曲线下面积、LDH、胰高血糖素 (GC) 和丙酮酸并增加 STZ 诱导的糖尿病小鼠的空腹胰岛素 (FINS) 水平,表明该提取物可以减轻高血糖和高脂血症,抑制 DN 进展和发展;它是治疗或预防 DN 的潜在候选药物(Yang et al., 2019a)。
杨桃叶中的总黄酮(TFACL,每日剂量为 0.2、0.4 和 0.8 g/kg,ig 7 天)可显着降低患有糖尿病的小鼠和大鼠的 FBG 水平并增强葡萄糖耐量。 STZ 诱导的糖尿病小鼠还口服杨桃乙醇提取物(EEACB)(连续三天每日剂量 50 和 100 mg/kg),口服 150 分钟后血糖水平急剧下降。单剂量葡萄糖溶液(1.0 g/kg); 100 mg/kg EEACB 比 50 mg/kg EEACB 引发更高的血糖水平下降(Islam 等人,2020)。这些结果表明杨桃是一种潜在的预防和治疗糖尿病的降血糖药物。
如前所述,从杨桃中分离和鉴定的一些化合物,包括47、48、100、101、120和121 ,已经测试了它们潜在的体内抗高血糖活性。正常高血糖大鼠接受口服从杨桃中提取的类黄酮杨桃黄酮 A(剂量为 20 和 50 mg/kg)( 47 )和杨桃黄酮 B(剂量为 20 和 50 mg/kg)(48)治疗后,血糖水平下降,表明潜在的降血糖作用。肌肉和肝脏中的糖原水平也急剧增加(Cazarolli 等,2012)。同一作者的另一项研究还发现,50 mg/kg 的杨桃黄酮 B (48)可以显着降低糖尿病大鼠的血糖水平,并在口服治疗高血糖大鼠后激发葡萄糖触发的胰岛素分泌。此外,观察到化合物48(浓度为 50 和 100 μM)对14 C-葡萄糖摄取具有显着的刺激功能,但用抑制剂(包括渥曼青霉素、RO318220 和 PD98059)治疗可逆转这种活性。有趣的是,100 μM 化合物48和 10 nM 胰岛素对葡萄糖摄取没有协同作用(Cazarolli 等,2009)。
从杨桃根中分离出的手性木脂素糖苷 (±)-lyoniresinol 3α-O-β-D-吡喃葡萄糖苷(LGP1 (105)和 LGP2 (106))已在 LGP1 和 LGP2 介导的健康促进特性中进行了评估低血糖对 STZ 产生的糖尿病小鼠肾损伤的影响。接受 LGP1 和 LGP2(每日剂量 20、40 和 80 mg/kg,持续 14 天)的糖尿病小鼠产生了截然不同的结果。虽然 LGP1 显着减轻了肾脏的组织病理学变化,并降低了 FBG、FINS 和胰岛素敏感性指数 (ISI) 水平以及 caspase-3/8/9、Bax 和 NF-κB 蛋白表达,但 LGP2 没有影响(Wen 等) ., 2013 ),表明 LGP1 可以通过调节多个分子靶点来减弱和治疗 DN 的进展。
还对从杨桃根中分离出的苯醌 ( 121 )进行了分析,并以 30、60 和 120 mg/kg 的剂量每天 ig 一次,持续 21 天。它能有效降低STZ诱导的糖尿病大鼠血清FBG、TC、TG、FFA、MCP-1、TNF-α、GHb、FINS、MDA和IL-6水平,并增加SOD和GSH活性。从机制上讲,该提取物显着下调胰腺组织中 TNF-α、IL-6、MyD88、p-NF-κB 和 TLR4 的表达(Qin 等,2019;Qin 等,2020)。这些发现表明苯醌 ( 121 ) 对 STZ 诱导的高血糖具有保护作用,其影响的潜在分子机制可能与抑制 TLR4/NF-κB 信号通路的激活有关。
研究人员从杨桃中分离出DMDD (122)(每日剂量为 12.5、25 和 50 mg/kg,ig 56 天)可显着降低 FBG、肌酐清除率、蛋白尿、Scr 和血清尿素氮含量和肾小球系膜基质扩张。它还显着改善糖尿病小鼠肾脏 AGE 形成,降低 AGE 受体、NF-κB、TGF-β1 和 N ε -(羧甲基)赖氨酸表达,并有效缓解 2 型糖尿病 KKAy 小鼠的 DN。然而,DMDD 如何缓解 DN 的根本机制尚未得到证实;因此,DMDD对抗DN的精确作用机制有待进一步探索( Lu et al., 2019 )。 TLR4 敲除 (TLR4 −/− , KO) 和野生型 (WT) 小鼠口服 DMDD(剂量为 12.5、25 和 50 mg/kg,持续 28 天)后,STZ 建立的 DN降低了血清 TC、TG、 HDL-C、LDL-C、血糖含量和肾功能标志物(包括 Scr 和 BUN)显着增加,足细胞的数量和密度显着增加,有助于缓解 DN 症状。该治疗还显着抑制 IL-6 和 TNF-α 水平并阻断 TLR4/MyD88/NF-κB 信号通路。然而,这些效应在 TLR4 −/−小鼠中显着不同。在体外,30 μM DMDD 显着抑制高糖 (HG) 刺激的 HK-2 细胞中 TLR4、Smad2 和 Smad3 的表达,并减少 BMP 和激活素膜结合抑制剂 (BAMBI) 的表达 ( Zhang et al., 2019 )。此外,在用 TAK-242(一种 TLR4 信号抑制剂)处理的细胞中,HG 培养细胞中 Smad2/3 表达的增加和 BAMBI 表达的减少明显消失。更重要的是,BAMBI 基因沉默显着增强了上皮间质转化 (EMT) 过程,而其过度表达在 HG 条件下的 HK-2 细胞中则相反。对 HK-2 细胞预先施用 DMDD 可缓解 EMT,这表明 DMDD通过抑制 TLR4/BAMBI/Smad2/3 信号通路对 HG 诱导的 HK-2 细胞 EMT 具有保护作用 ( Zhang et al., 2019))。这些发现表明从杨桃中分离出的 DMDD是治疗糖尿病肾病的潜在治疗药物。
研究从杨桃中分离出的 DMDD 对患有糖尿病肾病的野生型和 TLR4 敲除小鼠的抗糖尿病活性,DMDD(每日剂量为 12.5、25 和 50 mg/kg,ig 28 天)引起尿白蛋白、TC、TG、LDL-C、FBG 和 CysC 水平显着降低。该提取物还明显减轻了病理变化和肾纤维化,但沉默 TLR4 基因则改善了病理。从机制上讲,DMDD治疗后肾组织中TLR4、TGF-β1、Smad2和Smad3蛋白表达显着下降。与野生型小鼠相比, TLR4 -/−小鼠中的 TGF-β1 和 Smad2/3 基因和蛋白表达也异常下降。此外,根据IHC结果,肾组织中TLR4、TGF-β1、Smad2和Smad3原位表达较强,但DMDD治疗后明显减弱。然而,与健康小鼠相比, TLR4 -/−小鼠中的 TGF-β1、Smad2 和 Smad3 水平并未显着增加( Zhang et al., 2020)。这些发现强烈表明,TLR4 对于 DMDD 对糖尿病小鼠肾功能不全的保护活性至关重要,并且降血糖和抗纤维化特性可以通过 TLR4/TGF 信号通路进行调节。
综上所述,杨桃可以通过增强抗氧化酶活性和降低炎症细胞因子水平来减轻大鼠模型的氧化损伤和炎症反应,从而导致胰岛素分泌,以及血糖和血脂代谢调节。还存在一些关于活性化合物及其相关机制的原始发现;然而,这些调查缺乏明确的迹象表明这些活性是否源于杨桃的单一物质或几种物质的协同作用;因此,在将其作为临床研究和探索杨桃药用价值的基础之前,必须进行进一步的评估。
6.3抗高血脂活性
心血管疾病(CVD)是全球最常见的死亡原因之一,高脂血症是其主要危险因素之一(Mahdavi 等,2020;Jayachandran 和 Qu,2021)。赫尔曼-拉拉等人研究来自杨桃的微粉化不溶性纤维作为功能性食品 (FF) 或微粉化不溶性纤维富集部分 (IFRF) 的成分的保护活性及其体内对脂质代谢的影响小鼠模型经IFRF和FF处理后,血清TG、TC、HDL-C和LDL-C均下降,IFRF相应的抑制率分别为14.2、25.4、55.06和12.18%,IFRF相应的抑制率为30.18、39.47, 35.11%,FF 43.18%。 IFRF治疗还产生了较高的降血脂活性,大大避免了非酒精性脂肪肝的发生。总体而言,IFRF 和 FF 具有降血脂功效,表明杨桃的不溶性纤维可能是 FF 的一个组成部分,可用于治疗和预防 CVD(Herman-Lara 等,2014)。
在萨吉尔等人研究中,对杨桃各部位(如叶、茎、成熟和未成熟果实)的甲醇提取物和水提取物的抗高血脂活性进行了研究,他们发现杨桃的甲醇提取物(MEACL)具有在泊洛沙姆-407诱导的高脂血症大鼠中具有最有效的降血脂作用,并有效降低血清TC、TG、LDL-C、VLDL-C和动脉粥样硬化指数(AI)水平。 MEACL(每日剂量为 250、500 和 1,000 mg/kg,灌胃 35 天)显着降低血清和肝脏脂质水平,包括 TC、TG、LDL-C、VLDL-C 和 AI,HDL-C 升高,并且剂量依赖性地减轻了 HFD 诱导的高脂血症大鼠肝脏的组织病理学变化。杨桃的甲醇提取物(MEACL)还显着增强了 GSH、GSH-Px、SOD 和 CAT 活性并降低了 MDA 水平。此外,杨桃的甲醇提取物(MEACL)治疗抑制 HMG-CoA 还原酶和脂肪酶(Aladaileh 等人,2019)。这些结果表明,杨桃具有降血脂活性,它可以通过改善 HFD 喂养的大鼠的脂质过氧化和抗氧化防御来发挥作用。
6.4抗肥胖活动
肥胖相关疾病日益成为常见的公共卫生和社会问题。它们可引起多种代谢紊乱,与许多慢性疾病的风险增加密切相关(Zhu et al., 2015;Li et al., 2016)。一项研究发现,一些植物化学物质可抑制脂肪生成和肥胖。根据拉希德等人的说法,在他们的研究中,杨桃果皮的粗提物(CEPAC)(浓度为 10、100、500 和 1,000 mg/ml)剂量依赖性地抑制 TG 积累。此外,1,000 mg/ml的杨桃果皮的粗提物(CEPAC)基本上阻断了3T3-L1前脂肪细胞中的大部分脂肪细胞分化,且没有毒性。该提取物还显着降低了两种主要脂肪形成转录因子 PPAR-γ 和 C/EBPα 的 mRNA 表达,并在分子水平上增加了 PPAR-α 受体。在进一步的植物化学分析中,作者认识到 (-)-表儿茶素是一种天然生物活性分子,具有上述特征(Rashid 等人,2016)。这些发现表明杨桃果皮的粗提物(CEPAC)在治疗肥胖和肥胖相关疾病方面具有潜在前景。
李佩尔等人调查了 DMDD 对小鼠高脂饮食 (HFD) 引起的肥胖和胰岛素抵抗的益处,DMDD(每日剂量 12.5、25 和 50 mg/kg,灌胃 28 天)显着降低了体重和脂肪组织重量,并降低血清中胰岛素、血糖、TC、TG、FFA、IL-6 和 TNF-α 水平。 DMDD还显着下调附睾脂肪组织中的TLR4和MyD88蛋白水平,显着增强胰岛素分泌,降低曲线下面积,显着提高SOD和GSH-Px活性,并降低小鼠肝组织中的MDA含量(Li et al., 2016))。基于这些结果,DMDD 具有潜在的益处,可用于治疗 HFD 引起的肥胖和胰岛素抵抗,潜在地改善脂质代谢过程并抑制脂肪组织中 TLR4 蛋白的表达。
6.5抗肿瘤活性
多项研究表明,杨桃在体内和体外对多种肿瘤细胞具有显着的抑制活性,并揭示了杨桃粗提物或分离化合物抗肿瘤活性的可能机制(表2和图5)。 DENA 诱导和 CCl 4促进的肝癌小鼠口服杨桃提取物(ACE,剂量为 25 mg/kg,持续 5 天),结果 ACE 显着降低了肿瘤发生率、肿瘤产量和肿瘤负荷。该治疗还显着降低了脂质过氧化 (LPO) 水平并提高了 GSH、SOD、CAT 活性(Singh 等,2014)。这些发现提示ACE能够对小鼠肝癌发挥保护作用,可以作为一种良好的天然抗癌化疗产品来进一步筛选活性成分。据推测,杨桃的甲醇提取物(MEACL)(25 和 50 mg/kg,每天 ig 一次,持续 5 天)可显着降低艾利希腹水癌 (EAC) 的体重和细胞活力,延长生存时间,并改善血液学参数(HGB、WBC、RBC)的改变携带细胞的小鼠。 杨桃的甲醇提取物(MEACL)可以通过在分子水平上调p53和Bax蛋白表达来诱导癌细胞凋亡( Siddika et al., 2020 )。
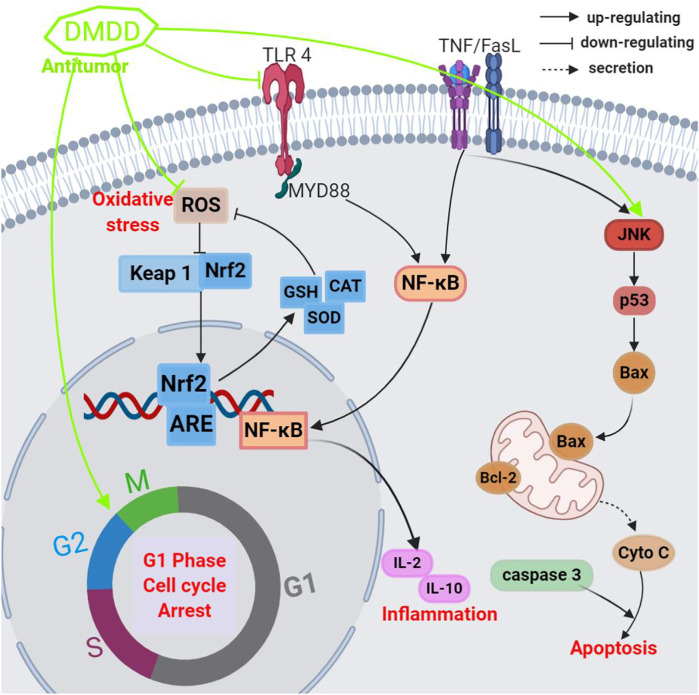
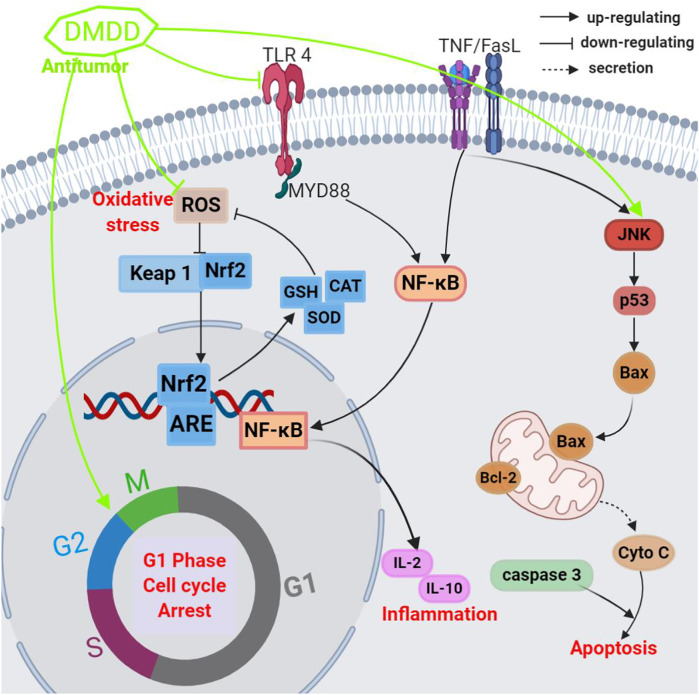
研究人员还表明杨桃活性物质DMDD显着抑制乳腺癌MCF-7和BT20细胞的生长,IC 50值范围为3.13至5.57 μM;杨桃活性物质DMDD通过诱导细胞凋亡并阻断细胞周期G1期,增加细胞内ROS的产生,激活外源性受体和内源性线粒体途径并抑制NF-κB活化来发挥抗癌特性。一项使用携带 4T1 乳腺癌细胞的小鼠进行体内研究的研究表明,杨桃活性物质DMDD可以从根本上抑制原发性乳腺肿瘤的生长,抑制乳腺肿瘤在肺和肝中的转移,并减少炎症细胞因子的产生,诱导细胞凋亡,并阻止激活TNF-α/NF-κB/MMPs 通路,延长荷瘤小鼠的生存时间 ( Chen et al., 2017b )。这些结果表明杨桃活性物质DMDD具有有效的抗肿瘤特性,可以帮助治疗转移性乳腺癌。
穆罕默德等人通过分析体内2小时和24小时处理组与未处理对照组的 TIE 和 TRD,探讨了用从杨桃中提取的 DMDD 处理的 4T1 肿瘤细胞的放射敏感性。阈值电离能(TIE)和阈值辐射剂量(TRD)是利用一种新颖的方法确定的,该方法采用激光捕获技术进行单细胞和多细胞电离。研究结果显示,治疗周期增加,TIE 和 TRD 显着减少,表明杨桃活性物质DMDD对 4T1 细胞放射敏感性具有强大的增强作用。然而,无论干预如何,TRD 都会随着质量的增加而减少。即使在治疗后,每组内单细胞电离与多细胞电离的 TRD 分析也持续显示出相同的行为。这些观察到的关系的基本要素可以用辐射、高热和化疗效应来解释(Muhammed et al., 2019)。 DMDD处理(4.0、6.0和8.0 μg/ml,24 h)可显着且剂量依赖性地抑制H1299细胞的增殖、迁移和侵袭,抑制率分别为22.50、30.13和58.87%。分别。同一研究确定杨桃活性物质DMDD还能诱导H1299细胞凋亡,其机制可能与抑制ERK/MAPK通路有关( Zhou et al., 2019 )。
研究人员通过裸鼠评估杨桃活性物质DMDD对肝癌的抗肿瘤作用及其机制,小鼠肿瘤重量显着下降,每日口服治疗后,3个剂量的抑瘤率分别为66.39、63.11和47.33% ,DMDD 剂量为 25、50 和 100 mg/kg,持续 12 天。肝脏、脾脏等肿瘤及脏器指标以及血清IL-2、IL-10水平也显着降低,WBC、HGB、PLT含量显着升高。此外,TLR4、MyD88和NF-κB的表达显着降低。这些结果表明杨桃活性物质DMDD具有良好的抗癌特性,其作用机制可能与抑制 TLR4/MyD88/NF-κB 信号通路有关。
6.6抗炎活性
对杨桃乙醇提取物 (EEACL)、其乙酸乙酯、丁醇和己烷馏分以及两种黄酮类化合物对巴豆油刺激性耳水肿小鼠皮肤炎症的抗炎作用的评估表明,局部使用杨桃乙醇提取物EEACL(浓度为0.03-1.0 mg/耳)可剂量依赖性地缩小水肿,浓度为0.02-0.13 mg/耳时ID 50值为0.05,浓度为0.6 mg/耳时最大抑制率为73%。 杨桃乙醇提取物 (EEACL)还抑制髓过氧化物酶 (MPO) 活性,ID 50值为 0.22,浓度为 0.6 mg/耳时最大抑制率为 61%。此外,所有检查的部分均显着抑制了水肿形成并降低了 MPO 活性。其他评估发现,杨桃乙醇提取物 (EEACL)的乙酸乙酯部分是 MPO 活性和水肿形成最有效的抑制剂,抑制率分别为 54% 和 75%(Cabrini 等,2011)。遗憾的是,杨桃乙醇提取物 (EEACL)对抗皮肤炎症的生物活性物质迄今为止尚未经过广泛测试;因此,它们需要进一步审查以优化并开发成预防和治疗皮肤病的有效疗法。
对从杨桃果实中提取的均质多糖(PFSCW,分子量40 kDa)进行 GC-MS 分析,确定其主要由阿拉伯糖、半乳糖和半乳糖醛酸组成,摩尔比为 12.3:1.7:86.0。甲基化和核磁共振波谱检查鉴定出由 (1→4)-连接的-α-D-Galp A 单元组成的取代半乳糖醛酸,在 O-2 处有一个分支,由 (1→5)-连接的-α-L-Araf 和末端- α-L-Araf 和 α-D-Galp A 单元作为 PFSCW 的组成部分。 PFSCW 治疗(剂量为 100 和 300 mg/kg)可显着减轻跖内注射福尔马林的爪水肿,剂量为 300 mg/kg 时抑制率为 53%,表明该提取物具有中等抗炎特性(Leivas等人,2016a)。谢等人。 (2016)证明杨桃活性物质DMDD(浓度为 10、15 和 20 μM)通过强烈阻碍 TLR4/MyD88/NF-KB 通路,显着抑制棕榈酸 (PA) 刺激的胰腺 Min6 细胞炎症,从而降低炎症细胞因子(TNF-α、IL-6 和 MCP-1),下调 cleaved-caspase-3/8/9 蛋白表达,升高 Bcl-2/Bax 比率,并降低 TLR4、MyD88 和 NF-KB 蛋白表达式。这些结果暗示杨桃活性物质DMDD能够通过减轻细胞凋亡和炎症反应来逆转 PA 刺激的 Min6 细胞功能障碍,其潜在作用机制几乎肯定与 TLR4/MyD88/NF-κB 信号通路的抑制有关。
6.7保肝活性
为了阐明调节肝脏脂肪生成的潜在作用机制,对杨桃游离酚提取物 (FPEAC) 在瘦素受体缺陷小鼠中的肝脏脂肪变性缓解活性进行了评估,发现杨桃游离酚提取物FPEAC(每日剂量10、20 和 30 g/kg,ig 持续 8 周)显着降低 LDL-C、TG、TC、非酯化脂肪酸 (NEFA) 水平以及 AST 和 ALT 活性,升高血清 HDL-C 水平,并降低肝脏中TG含量。从机械角度来看,杨桃游离酚提取物FPEAC 显着下调肝组织中甾醇调节元件结合蛋白-1c (SREBP-1c)、脂肪酸合酶 (FAS) 和硬脂酰辅酶 A 去饱和酶 1 (SCD1) 的表达,并显着上调 p-AMPK α 水平。更重要的是,杨桃游离酚提取物FPEAC显着下调microRNA-34a和microRNA-33的表达,从而调节AMPK/SREBP-1c/FAS信号通路( Pang et al., 2017 )。这些发现表明,杨桃游离酚提取物FPEAC 具有引人注目的肝脏脂肪变性缓解作用,部分是通过抑制肝脏脂肪生成的信号传递来实现的。杨桃(FJAC,每日剂量为 5、10 和 20 g/kg,ig 14 天)显示出潜在的保肝特性;它降低了 STZ 诱导的糖尿病小鼠肝脏中的 MAD 和 cAMP 水平,并增加了 SDH、MDA 和 SOD 活性。
在一项研究中,患有急性肝损伤的小鼠服用杨桃提取物(EACR,每日剂量为 0.3、0.6 和 1.2 g/kg,持续 7 天)后,其血清 CCl 4、AST、ALT、IL-显着降低。 1、IL-6 水平和肝脏 MDA 水平,但 SOD、GSH 和 GSH-Px 活性显着增加。在分子水平上,肝脏中TNF-α、NF-κB和caspase-3蛋白表达显着下调。 HE染色显示肝损伤得到缓解( Huang et al., 2019 )。在另一项研究中,杨桃提取物EACR(每日剂量为 0.25、0.5 和 1.0 g/kg,ig 持续 28 天)显着增加了肝脏中的白蛋白/球蛋白 (A/G) 比率,降低了肝脏中的总胆红素 (TBIL) 和 TC 水平CCl 4诱导的肝纤维化(HF)大鼠的微观结构,NF-κB和Bax蛋白表达显着减少,Bcl-2蛋白表达显着增加(Liang et al., 2020b)。 CCl 4引起的慢性肝损伤大鼠灌胃给予 EACR(剂量为 0.25、0.5 和 1.0 g/kg,持续 56 天),血清 AST、ALT、AKP 和 Hyp 含量、血清肝纤维化生物标志物 (HA) 显着降低。 、LN、Col III 和 Col IV)和肝组织 MDA 含量以及 SOD 和 GSH-Px 能力增加。 EACR 还显着逆转 COL-1a1、α-SMA、TIMP2、TGF-β1、Smad-2 和 -4 mRNA 表达的升高,并抑制 α-SMA、TIMP2、TGF-β1、Smad-2、-3、- 4、肝组织中的Bax和caspase-3水平。此外,提取物显着增加肝脏中 Smad-7 mRNA 表达以及 Smad-7 和 Bcl-2 蛋白水平(Huang et al., 2020)。这些发现表明杨桃提取物EACR是治疗肝纤维化的一种有前途的药物。然而,必须紧急进行进一步的研究来确定 杨桃提取物EACR 抗纤维化作用的生物活性成分和可能的机制。
6.8心脏保护活动
心室重塑(VR)导致内皮血管活性物质的变化、心肌细胞肥大、心肌纤维化和内皮功能障碍。梁佩尔等人研究杨桃水提取物(AEAC) 对 VR、AEAC 大鼠异丙肾上腺素刺激的内皮功能的保护作用(每日剂量 50、100 和 200 mg/kg,ig 14 天)显着降低血清 iNOS、TGF-β、Ang II、ECE 和 ET-1 水平及其蛋白表达,降低 VR 指数和 CVF,但显着升高血清 tNOS 和 eNOS 水平及其蛋白表达。病理学评估表明,杨桃水提取物AEAC从根本上减轻了大鼠心肌组织的炎症浸润、细胞凋亡、纤维化和坏死,这表明 杨桃水提取物AEAC 可能减轻大鼠的 VR,因此可能与维护血管活性成分和血管内皮功能的平衡有关。等人,2020a)。另一项研究表明,高糖高脂饮食联合STZ诱导DMDD(剂量为12.5、25、50、100mg/kg/天,ig,连续21天)的糖尿病小鼠模型效果显着。减轻心肌组织损伤,抑制心肌细胞凋亡,降低FBG、LVEDP、ROS、MDA、Beclin-1、LC3II/I、Atg5水平,升高SOD、p-PI3K/PI3K、p-Akt /Akt 和 p-mTOR/mTOR,表明 杨桃活性物质DMDD通过调节 ROS 介导的 PI3K/Akt/mTOR 自噬途径发挥心脏保护活性(表2; Ma 等人,2021)。
6.9抗高血压活性
研究人员对离体大鼠主动脉中杨桃水提取物 (AEAC) 的抗高血压作用及其可能机制的研究,杨桃水提取物 (AEAC) 治疗(剂量为 12.5–50.0 mg/kg,静脉注射)导致血压正常的大鼠平均动脉压(MAP)显着降低,呈剂量依赖性。在体外,杨桃水提取物 (AEAC) 降低了对去氧肾上腺素的E max反应,但没有引起敏感性变化。杨桃水提取物 (AEAC) 还抑制 CaCl 2刺激的主动脉收缩,并导致去极化无 Ca 2+介质的反应曲线向右移动,表明提取物抑制细胞外 Ca 2+流入并引起血管收缩。这些结果有力地支持了杨桃治疗高血压的传统用途。
口服杨桃乙醇提取物(EEACR,150、300 和 600 mg/kg)已被证明可以降低健康大鼠的血压(300 和 600 mg/kg),但对心率没有明显影响(唐等人,2017)。研究人员调查了杨桃中的黄酮类化合物(FACF) 对健康大鼠和 NG-硝基-L-精氨酸甲酯 (L-NAME) 诱导的高血压大鼠的影响,他们确定 FACF(每天剂量为 300、600 和 1,200 mg/kg,灌胃注射 5 周)可显着降低健康大鼠的收缩压、舒张压和平均血压。此外,高血压大鼠的血压也通过 600 和 1,200 mg/kg FAC 治疗而显着降低,这表明杨桃中的黄酮类化合物FACF含有一种降低血压的活性成分(黄等人,2017)。
6.10神经保护活性
阿尔茨海默病(AD)以学习、记忆和认知的进行性恶化为特征,是最常见的、不可逆的进行性神经退行性疾病(Robins Wahlin 和 Byrne,2011;Levenson 等,2014)。据报道,杨桃活性物质DMDD 对 APP/PS1 转基因 AD 小鼠的记忆缺陷和神经元凋亡具有神经保护作用(Wei et al., 2018)。该研究表明,口服杨桃活性物质DMDD(每日剂量为 12.5、25 和 50 mg/kg,持续 21 天)的小鼠表现出记忆力和空间学习能力显着改善,并抑制 APP/PS1 海马组织中的神经元丢失和凋亡。在体外,杨桃活性物质DMDD(浓度为5、10和20 μmol/L)通过上调Bcl-2表达和下调Bax表达、增加线粒体膜电位(MMP)和激活PC-12来从根本上抑制Aβ1-42刺激的细胞凋亡细胞 caspase-3 和 caspase-9。用杨桃活性物质DMDD 预处理的小鼠在体外和体内的PC-12 细胞 Bcl-2/Bax 比率也显着增加( Wei et al., 2018 )。这些发现表明,杨桃活性物质DMDD 通过改善神经元凋亡和抑制 Bax/Bcl-2 介导的 MMP 损失,具有对抗 APP/PS1 转基因 AD 小鼠学习和记忆缺陷的有益特性。
最近,研究人员探讨了杨桃活性物质DMDD对 Aβ1-42 诱发的 SH-SY5Y 细胞凋亡的神经保护活性以及 DMDD 保护功能的潜在机制。 杨桃活性物质DMDD(浓度为5、10和20 μmol/L)处理显着增加细胞活力并抑制Aβ1-42诱导的SH-SY5Y细胞凋亡。从机制上讲,DMDD 显着下调 Bax、caspase-3、caspase-8 和 caspase-9 的表达,上调 Bcl-2 水平,抑制细胞色素 c 的释放和 MMP 的丢失,并提高 Bcl-2/Bax 比值。卢等人,2020)。总体而言,杨桃活性物质DMDD 显示出优异的神经保护特性,是开发阿尔茨海默病神经保护药物的有前途的成分。
6.11减少紫外线 B 引起的皮肤损伤
紫外线 B (UVB) 是细胞损伤和皮肤癌的主要致病因素。它会引起 DNA 损伤、促进细胞凋亡并产生 ROS。Ronpirin 等人研究了杨桃对 UVB 引起的 HaCaT 角质形成细胞的保护作用,杨桃的乙醇和水提取物(EFAC 和 AFAC,浓度为 250 µg/ml)显着减少了细胞凋亡。两种组分还显着降低了 caspase 3 蛋白的表达。此外,杨桃乙醇提取物EFAC(浓度为 100 和 250 µg/ml)和杨桃水提取物AFAC(浓度为 50、100 和 250 µg/ml)大大降低了环丁烷嘧啶二聚体 (CPD) 的百分比,从而实现 DNA 修复(Ronpirin 等人,2016)。这些报告表明,杨桃提取物可以用于美容,以防止 UVB 引起的皮肤损伤。
6.12抗菌活性
杨桃的茎皮、叶子和果实的提取物具有抗菌和抗真菌活性。先前的研究表明,杨桃果实提取物可以抑制金黄色葡萄球菌和克雷伯氏菌的生长,其MBC分别为15.62和125 mg/ml(Chang et al., 2000)。此外,从杨桃中分离出的两种化合物对茴香醛和β-谷甾醇(400 μg/盘)对大肠杆菌的生长具有强烈的抑制作用,抑菌圈达15 mm,对真菌具有中等的抑制活性(Mia et al.等,2007)。随后,Wakte 和 Patil (2011)筛选了不同阶段的杨桃果实提取物对两种革兰氏阳性菌(金黄色葡萄球菌ATCC 6538P 和蜡样芽孢杆菌ATCC 11778)和三种革兰氏阴性菌(大肠杆菌)的抗菌活性。 ATCC 25922、铜绿假单胞菌ATCC 19429 和鼠伤寒沙门氏菌ATCC 23564),结果发现所有提取物均表现出不同程度的对抗革兰氏阳性菌和革兰氏阴性菌的活性,且甲醇和丙酮提取物的效果明显优于其他溶剂提取物对革兰氏阳性微生物的抑制作用优于革兰氏阴性微生物。此外,发现剂量为 250 和 500 µg/片的杨桃乙醇提取物可适度抑制痢疾志贺氏菌、化脓性链球菌、腐生葡萄球菌、无乳链球菌和假单胞菌属的生长 (侯赛因等人,2017)。
最近,席尔瓦等人发现杨桃的茎皮、叶子和果实提取物可明显抑制多重耐药病原菌和真菌的生长,最低抑菌浓度 (MIC) 为 100 μg/ml。叶子的粗提取物对革兰氏阳性和革兰氏阴性细菌表现出广谱作用,例如金黄色葡萄球菌10 MRSA、金黄色葡萄球菌ATCC 29213 MRSA、金黄色葡萄球菌12 MRSA、金黄色葡萄球菌6 MRSA、K.肺炎链球菌8 ESBL、粪肠球菌ATCC 29212 和 A .鲍曼不动杆菌2 MBL(Silva 等人,2021)。总体而言,这些研究的结果提供了一个研究方向,指出杨桃对细菌和真菌感染的前瞻性治疗功效。
7.未来展望
本文综述了杨桃的植物学、民族药理学、植物化学、药理学和毒性,以探索这种珍贵的水果。杨桃的多汁和甜味引起了食品工业的兴趣。由于杨桃的营养特性以及各种健康和药理作用,制药和健康行业对杨桃越来越感兴趣。植物化学研究表明,已报道的132种化合物主要来自杨桃。以化合物47、48为代表的黄酮类化合物和以DMDD为代表的苯醌类化合物被认为是具有广泛生物学特性的生物活性成分,包括降血压、降血糖、降血脂、抗肥胖、抗炎、保肝、抗肿瘤、保护心脏等功能。大量研究表明,杨桃可能是治疗糖尿病和高血压相关疾病的有希望的候选者。此外,杨桃还可用于预防和治疗与衰老和氧化应激相关的疾病。综上所述,杨桃作为食品药用资源,具有良好的保健功能和重要的食用、药用价值,具有良好的利用前景。
然而,旨在弥合健康与杨桃生物活性物质之间差距的研究仍然存在许多问题,需要进一步研究:首先,尽管有大量的体外和体内研究集中在使用过高剂量的杨桃粗提物,据我们所知,这些粗提物中具有生物活性的活性物质仍然未知。因此,明确杨桃中活性成分的生物活性和作用机制的研究应该进一步深入开展,因为它们必将有助于建立安全剂量,并加快发现杨桃新分子的步伐。生物学兴趣。其次,在过去的几十年里,杨桃的生物活性化合物和粗提物已越来越多地成功地用于高血压疾病预防和健康促进。文件证据表明,杨桃中含有大量生物活性化合物和粗提物,可用作功能性食品来源,对抗各种疾病,包括高血压、糖尿病、癌症、心血管疾病和其他氧化应激或衰老引起的慢性疾病。需要进一步研究探索和利用该水果的加工产品,特别是杨桃中的酚类提取物和膳食纤维用于功能性食品配方。第三,虽然杨桃的毒性研究已有报道,但其毒性机制,特别是肾毒性和神经毒性的相关信息仍然缺乏。据报道,杨桃诱发的草酸盐肾病仍然是急性和慢性肾脏疾病的一个未被充分认识的原因。因此,应提高公众对尿毒症患者草酸盐中毒的认识。这将有助于避免高尿毒症患者对杨桃的不良反应。公众必须充分了解杨桃的好处和危害。此外,毒理学研究对于了解草药的安全性至关重要。因此,为保证其药用资源的充分利用,应进一步开展杨桃的急性毒性、亚急性毒性以及体外和体内的安全性评价研究。第四,需要继续努力阐明吸收、分布、代谢和排泄等药代动力学途径,评估长期慢性毒性和急性毒性以及体内形成的植物化学物质的代谢产物。在继续开发药物制剂之前,先了解生物活性化合物,尤其是 DMDD。药代动力学参数也有助于促进天然活性物质的合理优化,提高治疗效果并降低毒性。总体而言,迫切需要对临床研究进行深入研究,以证明杨桃的治疗潜力、临床疗效和安全性。
总而言之,由于杨桃具有众多的有益作用,人们对杨桃产生了极大的兴趣。杨桃在功能食品和现代医学领域具有巨大的发展潜力。因此,机遇与挑战并存。同时,它也是中医药走向国际市场的有效途径,也是发达国家现代医疗保健的理想选择,是维护人类健康、构建人类健康命运共同体的理想选择。我们相信杨桃将拥有广阔的国际市场,在医药和功能食品方面的应用前景广阔。
8.参考文献
- Aba P. E., Amadi A. U. (2020). Evaluation of the Possible Hepatotoxic and Nephrotoxic Potentials of the Averrhoa carambola Juice Extract in Female Albino Rats. J. Basic Clin. Physiol. Pharmacol. 31 (1), 20190042. 10.1515/jbcpp-2019-0042 [PubMed] [CrossRef] [Google Scholar]
- Abeysekera R. A., Wijetunge S., Nanayakkara N., Wazil A. W., Ratnatunga N. V., Jayalath T., et al. (2015). Star Fruit Toxicity: a Cause of Both Acute Kidney Injury and Chronic Kidney Disease: a Report of Two Cases. BMC Res. Notes 8, 796. 10.1186/s13104-015-1640-8 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Aladaileh S., Saghir S., Murugesu K., Sadikun A., Ahmad A., Kaur G., et al. (2019). Antihyperlipidemic and Antioxidant Effects of Averrhoa Carambola Extract in High-Fat Diet-Fed Rats. Biomedicines 7 (3), 72. 10.3390/biomedicines7030072 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Araho D., Miyakoshi M., Chou W. H., Kambara T., Mizutani K., Ikeda T. (2005). A New Flavone C-Glycoside from the Leaves of Averrhoa Carambola . Nat. Med. 59, 113–116. 10.1016/j.apsusc.2004.03.089 [CrossRef] [Google Scholar]
- Aranguren C., Vergara C., Rosselli D. (2017). Toxicity of Star Fruit (Averrhoa carambola) in Renal Patients: A Systematic Review of the Literature. Saudi J. Kidney Dis. Transpl. 28 (4), 709–715. [PubMed] [Google Scholar]
- Bahramsoltani R., Kalkhorani M., Abbas Zaidi S. M., Farzaei M. H., Rahimi R. (2020). The Genus Tamarix: Traditional Uses, Phytochemistry, and Pharmacology. J. Ethnopharmacol. 246, 112245. 10.1016/j.jep.2019.112245 [PubMed] [CrossRef] [Google Scholar]
- Benkeblia N., Lopez M. G. (2015). Saccharides and Fructooligosaccharides Composition of Green and Ripe Averrhoa carambola, Blighia sapida and Spondias dulcis Fruits. Food Chem. 176, 314–318. 10.1016/j.foodchem.2014.12.080 [PubMed] [CrossRef] [Google Scholar]
- Bhat R., Ameran S. B., Voon H. C., Karim A. A., Tze L. M. (2011). Quality Attributes of Starfruit (Averrhoa carambola L.) Juice Treated with Ultraviolet Radiation. Food Chem. 127 (2), 641–644. 10.1016/j.foodchem.2011.01.042 [PubMed] [CrossRef] [Google Scholar]
- Bircher A. G., Bircher W. H. (2000). Encyclopedia of Fruit Trees and Edible Flowering Plants in Egypt and the Subtropics. Cairo, Egypt: American University in Cairo Press, 596. [Google Scholar]
- Cabrini D. A., Moresco H. H., Imazu P., da Silva C. D., Pietrovski E. F., Mendes D. A., et al. (2011). Analysis of the Potential Topical Anti-inflammatory Activity of Averrhoa carambola L. in Mice. Evid. Based Complement. Alternat Med. 2011, 908059. 10.1093/ecam/neq026 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Carolino R., Beleboni R., Pizzo A., Vecchio F., Garciacairasco N., Moysesneto M., et al. (2005). Convulsant Activity and Neurochemical Alterations Induced by a Fraction Obtained from Fruit (Oxalidaceae: Geraniales). Neurochem. Int. 46 (7), 523–531. 10.1016/j.neuint.2005.02.002 [PubMed] [CrossRef] [Google Scholar]
- Cazarolli L. H., Folador P., Moresco H. H., Brighente I. M. C., Pizzolatti M. G., Silva F. R. M. B. (2009). Mechanism of Action of the Stimulatory Effect of Apigenin-6-C-(2″-O-α-l-Rhamnopyranosyl)-β-L-Fucopyranoside on 14C-Glucose Uptake. Chem. Biol. Interact. 179, 407–412. 10.1016/j.cbi.2008.11.012 [PubMed] [CrossRef] [Google Scholar]
- Cazarolli L. H., Kappel V. D., Pereira D. F., Moresco H. H., Brighente I. M. C., Pizzolatti M. G., et al. (2012). Anti-hyperglycemic Action of Apigenin-6-C-β-Fucopyranoside from Averrhoa Carambola. Fitoterapia 83, 1176–1183. 10.1016/j.fitote.2012.07.003 [PubMed] [CrossRef] [Google Scholar]
- Chakthong S., Chiraphan C., Jundee C., Chaowalit P., Voravuthikunchai S. P. (2010). Alkyl Phenols from the wood of Averrhoa Carambola . Chin. Chem. Lett. 21, 1094–1096. 10.1016/j.cclet.2010.03.031 [CrossRef] [Google Scholar]
- Chang J. M., Hwang S. J., Kuo H. T., Tsai J. C., Guh J. Y., Chen H. C., et al. (2000). Fatal Outcome after Ingestion of Star Fruit (Averrhoa carambola) in Uremic Patients. Am. J. Kidney Dis. 35 (2), 189–193. 10.1016/s0272-6386(00)70325-8 [PubMed] [CrossRef] [Google Scholar]
- Chen C. L., Fang H. C., Chou K. J., Wang J. S., Chung H. M. (2001). Acute Oxalate Nephropathy after Ingestion of star Fruit. Am. J. Kidney Dis. 37 (2), 418–422. 10.1053/ajkd.2001.21333 [PubMed] [CrossRef] [Google Scholar]
- Chen C. X., Nong Z. H., Xie Q. Q., He J. H., Cai W. E., Tang X. N., et al. (2017b). 2-dodecyl-6-Methoxycyclohexa-2,5-Diene-1,4-Dione Inhibits the Growth and Metastasis of Breast Carcinoma in Mice. Sci. Rep. 7 (1), 6704. 10.1038/s41598-017-07162-3 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Chen G. L., Zhang X., Chen S. G., Han M. D., Gao Y. Q. (2017a). Antioxidant Activities and Contents of Free, Esterified and Insoluble-Bound Phenolics in 14 Subtropical Fruit Leaves Collected from the South of China. J. Funct. Foods 30, 290–302. 10.1016/j.jff.2017.01.011 [CrossRef] [Google Scholar]
- Chen L., Lu X., El-Seedi H., Teng H. (2019). Recent Advances in the Development of Sesquiterpenoids in the Treatment of Type 2 Diabetes. Trends Food Sci. Technol. 88, 46–56. 10.1016/j.tifs.2019.02.003 [CrossRef] [Google Scholar]
- Chua C. B., Sun C. K., Tsui H. W., Yang P. J., Lee K. H., Hsu C. W., et al. (2017). Association of Renal Function and Symptoms with Mortality in star Fruit (Averrhoa carambola) Intoxication. Clin. Toxicol. 55 (7), 624–628. 10.1080/15563650.2017.1314490 [PubMed] [CrossRef] [Google Scholar]
- Dembitsky V. M., Poovarodom S., Leontowicz H., Leontowicz M., Vearasilp S., Trakhtenberg S., et al. (2011). The Multiple Nutrition Properties of Some Exotic Fruits: Biological Activity and Active Metabolites. Food Res. Int. 44, 1671–1701. 10.1016/j.foodres.2011.03.003 [CrossRef] [Google Scholar]
- Fan Y. Y., Sahu S. K., Yang T., Mu W. X., Wei J. P., Cheng L., et al. (2020). Dissecting the Genome of star Fruit (Averrhoa carambola L.). Hortic. Res. 7, 94. 10.1038/s41438-020-0306-4 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Farias D. P., Neri-Numa I. A., de Araújo F. F., Pastore G. M. (2020). A Critical Review of Some Fruit Trees from the Myrtaceae Family as Promising Sources for Food Applications with Functional Claims. Food Chem. 306, 125630. 10.1016/j.foodchem.2019.125630 [PubMed] [CrossRef] [Google Scholar]
- Ferreira E. B., Fernandes L. C., Galende S. B., Cortez A. G., Bazotte R. B. (2008). Hypoglycemic Effect of the Hydroalcoholic Extract of Leaves of Averrhoa carambola L. (Oxalidaceae). Rev. Bras. Farmacogn. 18 (3), 339–343. 10.1590/s0102-695×2008000300005 [CrossRef] [Google Scholar]
- Flora of China Editorial Committee (1998). Flora of China. Beijing, China: Science Press. [Google Scholar]
- Gao Y., Huang R., Gong Y., Park H. S., Wen Q., Almosnid N. M., et al. (2015). The Antidiabetic Compound 2-Dodecyl-6-Methoxycyclohexa-2,5-Diene-1,4-Dione, Isolated from Averrhoa carambola L., Demonstrates Significant Antitumor Potential against Human Breast Cancer Cells. Oncotarget 6 (27), 24304–24319. 10.18632/oncotarget.4475 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Gunasegaran R. (1992). Flavonoids and Anthocyanins of Three Oxalidaceae. Fitoterapia 63, 89–90 . [Google Scholar]
- Gunawardena D. C., Jayasinghe L., Fujimoto Y. (2015). Phytotoxic Constituents of the Fruits of Averrhoa Carambola . Chem. Nat. Compd. 51 (3), 532–533. 10.1007/s10600-015-1332-6 [CrossRef] [Google Scholar]
- Herman-Lara E., Elvira-Torales L. I., Rodriguez-Miranda J., Torruco-Uco J. G., Carmona-García R., Mendoza-García P. G., et al. (2014). Impact of Micronized Starfruit (Averrhoa carambola L.) Fiber Concentrate on Lipid Metabolism in Mice. Int. J. Food Sci. Nutr. 65 (7), 862–867. 10.3109/09637486.2014.918590 [PubMed] [CrossRef] [Google Scholar]
- Hossain T., Barman A. K., Karmakar U. K., Bokshi B., Dev S., Biswas N. N. (2017). Phytochemical and Pharmacological Evaluation of Leaves of Averrhoa carambola Linn. (Family: Oxalidaceae). Biosci. Bioeng. Commun. 3 (1), 144–151. [Google Scholar]
- Huang W. S., Pham H. T. T., Xuan F. F., Li J. M., Huang R. B. (2017). Effects of Flavonoids Compound in Averrhoa carambola L. (Oxalidacaeae) Fruit (ACFTF) on Blood Pressure of Rats. China J. Tradit. Chin. Med. Pharm. 32 (4), 1786–1788. [Google Scholar]
- Huang X., Wang L., Meng M., Zhang S., Pham T. T. H., Jiang L., et al. (2020). Extract of Averrhoa carambola L. (Oxalidaceae) Roots Ameliorates Carbon Tetrachloride-Induced Hepatic Fibrosis in Rats. Biomed. Pharmacother. 121, 109516. 10.1016/j.biopha.2019.109516 [PubMed] [CrossRef] [Google Scholar]
- Huang X., Xie Q. Q., Ye F. X., Qin L. H., Huang R. B., Zhang S. J. (2019). Protective Effect of Extract of Averrhoa carambola L. Root on CCl4-Induced Acute Liver Injury in Mice. Chin. Pharmacol. Bull. 35 (1), 106–110. 10.3969/j.issn.1001-1978.2019.01.021 [CrossRef] [Google Scholar]
- Huynh N. K., Nguyen H. V. H. (2017). Effects of Juice Processing on Oxalate Contents in Carambola Juice Products. Plant Foods Hum. Nutr. 72 (3), 236–242. 10.1007/s11130-017-0615-4 [PubMed] [CrossRef] [Google Scholar]
- Islam S., Alam M. B., Ahmed A., Lee S., Lee S.-H., Kim S. (2020). Identification of Secondary Metabolites in Averrhoa carambola L. Bark by High-Resolution Mass Spectrometry and Evaluation for α-glucosidase, Tyrosinase, Elastase, and Antioxidant Potential. Food Chem. 332, 127377. 10.1016/j.foodchem.2020.127377 [PubMed] [CrossRef] [Google Scholar]
- Jayachandran M., Qu S. (2021). Harnessing Hyperuricemia to Atherosclerosis and Understanding its Mechanistic Dependence. Med. Res. Rev. 41, 616–629. 10.1002/med.21742 [PubMed] [CrossRef] [Google Scholar]
- Jia X., Xie H., Jiang Y., Wei X. (2018). Flavonoids Isolated from the Fresh Sweet Fruit of Averrhoa Carambola , Commonly Known as star Fruit. Phytochemistry 153, 156–162. 10.1016/j.phytochem.2018.06.007 [PubMed] [CrossRef] [Google Scholar]
- Jia X., Yang D., Xie H., Jiang Y., Wei X. (2017). Non-Flavonoid Phenolics from Averrhoa carambola Fresh Fruit. J. Funct. Foods 32, 419–425. 10.1016/j.jff.2017.03.025 [CrossRef] [Google Scholar]
- Jia X., Yang D., Yang Y., Xie H. (2019). Carotenoid-Derived Flavor Precursors from Averrhoa carambola Fresh Fruit. Molecules 24, 256. 10.3390/molecules24020256 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Lakmal K., Yasawardene P., Jayarajah U., Seneviratne S. L. (2021). Nutritional and Medicinal Properties of Star Fruit (Averrhoa carambola L.): A Review. Food Sci. Nutr. 9 (3), 1810–1823. 10.1002/fsn3.2135 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Leivas C. L., Iacomini M., Cordeiro L. M. C. (2016b). Pectic Type II Arabinogalactans from Starfruit (Averrhoa carambola L.). Food Chem. 199, 252–257. 10.1016/j.foodchem.2015.12.020 [PubMed] [CrossRef] [Google Scholar]
- Leivas C. L., Iacomini M., Cordeiro L. M. C. (2015). Structural Characterization of a Rhamnogalacturonan I-Arabinan-Type I Arabinogalactan Macromolecule from Starfruit (Averrhoa carambola L). Carbohydr. Polym. 121, 224–230. 10.1016/j.carbpol.2014.12.034 [PubMed] [CrossRef] [Google Scholar]
- Leivas C. L., Nascimento L. F., Barros W. M., Santos A. R. S., Iacomini M., Cordeiro L. M. C. (2016a). Substituted Galacturonan from Starfruit: Chemical Structure and Antinociceptive and Anti-Inflammatory Effects. Int. J. Biol. Macromol. 84, 295–300. 10.1016/j.ijbiomac.2015.12.034 [PubMed] [CrossRef] [Google Scholar]
- Levenson R. W., Sturm V. E., Haase C. M. (2014). Emotional and Behavioral Symptoms in Neurodegenerative Disease: a Model for Studying the Neural Bases of Psychopathology. Annu. Rev. Clin. Psychol. 10, 581–606. 10.1146/annurev-clinpsy-032813-153653 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Li J., Wei X., Xie Q., Hoa Pham T. T., Wei J., He P., et al. (2016). Protective Effects of 2-Dodecyl-6-Methoxycyclohexa-2,5 -Diene-1,4-Dione Isolated from Averrhoa Carambola L. (Oxalidaceae) Roots on High-Fat Diet-Induced Obesity and Insulin Resistance in Mice. Cell. Physiol. Biochem. 40 (5), 993–1004. 10.1159/000453156 [PubMed] [CrossRef] [Google Scholar]
- Liang C. X., Pham H. T. T., Zhang X. L., Liang X. M., Huang R. B., Huang X. (2020b). Effect of Extract of Averrhoa carambola L. Root on Liver Microstructure of Liver Fibrosis Rats. J. Guangxi Med. Univ. 37 (7), 1245–1249. 10.16190/j.cnki.45-1211/r.2020.07.008 [CrossRef] [Google Scholar]
- Liang X., Huang R., Huang J., Chen C., Qin F., Liu A., et al. (2020a). Effect of an Aqueous Extract of Averrhoa carambola L. on Endothelial Function in Rats with Ventricular Remodelling. Biomed. Pharmacother. 121, 109612. 10.1016/j.biopha.2019.109612 [PubMed] [CrossRef] [Google Scholar]
- Liao P. Y., Li D. P., Hu Z. Y., Chen H. P., Yang X. M., Wu Y. Y. (2019b). Extraction Process Optimization and In Vitro Activity Evaluation for Polysaccharides from Averrhoa carambola Roots. Chin. Tradit. Pat. Med. 41 (9), 2030–2034. 10.3969/j.issn.1001-1528.2019.09.002 [CrossRef] [Google Scholar]
- Liao P. Y., Zhou Z. Y., Chen Y. R., Chen H. P., Pan W. G., Yang X. M., et al. (2019a). Chemical Constituents of the Water Extracts of Averrhoa carambola L. Root and Their Biological Activities. Nat. Prod. Res. Dev. 31, 81–86. 10.16333/j.1001-6880.2019.1.013 [CrossRef] [Google Scholar]
- Liu F. Z., Song X. M., Wang X. L., Liu T., Liang R. F. (2013). Hypoglycemic Effect of Total Flavones from Averrhoa carambola L. Leaf. China J. Tradit. Chin. Med. Pharm. 19 (11), 279–281. 10.11653/syfj2013110279 [CrossRef] [Google Scholar]
- Lu S. Y., Wei X. J., Zhang H. L., Chen Z. F., Li J. M., Xu X. H., et al. (2020). Protective Effect of 2-Dodecyl-6-Methoxycyclohexa-2, 5-Diene-1, 4-Dione, Isolated from Averrhoa carambola L., Against Aβ1-42-Induced Apoptosis in SH-SY5Y Cells by Reversing Bcl-2/Bax Ratio. Psychopharmacology 238 (1), 193–200. 10.1007/s00213-020-05668-9 [PubMed] [CrossRef] [Google Scholar]
- Lu S., Zhang H., Wei X., Huang X., Chen L., Jiang L., et al. (2019). 2-Dodecyl-6-Methoxycyclohexa-2,5-Diene-1,4-Dione Isolated from Averrhoa carambola L. Root Ameliorates Diabetic Nephropathy by Inhibiting the TLR4/MyD88/NF-Κb Pathway. Diabetes Metab. Syndr. Obes. 12, 1355–1363. 10.2147/dmso.s209436 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Lu Y., Tan C. W., Chen D., Liu S.-Q. (2018). Potential of Three Probiotic Lactobacilli in Transforming Star Fruit Juice into Functional Beverages. Food Sci. Nutr. 6 (8), 2141–2150. 10.1002/fsn3.775 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ma J., Wu Y. N., Huang D. L., Zhou Y. P., Hou L. T., Li Y. K., et al. (2021). Averrhoa carambola L. Roots DMDD Alleviates Myocardial Injury in Diabetes Mellitus Mice by Regulating ROS-Mediated Autophagy Pathways. Chin. Pharmacol. Bull. 37 (6), 823–827. 10.3969/j.issn.1001-1978.2021.06.015 [CrossRef] [Google Scholar]
- Mahdavi A., Bagherniya M., Fakheran O., Reiner Ž., Xu S., Sahebkar A. (2020). Medicinal Plants and Bioactive Natural Compounds as Inhibitors of HMG-CoA Reductase: A Literature Review. Biofactors 46, 906–926. 10.1002/biof.1684 [PubMed] [CrossRef] [Google Scholar]
- Maqsood S., Adiamo O., Ahmad M., Mudgil P. (2020). Bioactive Compounds from Date Fruit and Seed as Potential Nutraceutical and Functional Food Ingredients. Food Chem. 308, 125522. 10.1016/j.foodchem.2019.125522 [PubMed] [CrossRef] [Google Scholar]
- Mia M., Rahman M., Begum K., Begum B., Rashid M. (2007). Phytochemical and Biological Studies of Averrhoa carambola . Dhaka Univ. J. Pharm. Sci. 6, 125–128. 10.3329/dujps.v6i2.688 [CrossRef] [Google Scholar]
- Mohd Suhaimi N. I., Mat Ropi A. A., Shaharuddin S. (2021). Safety and Quality Preservation of Starfruit (Averrhoa carambola) at Ambient Shelf Life Using Synergistic Pectin-Maltodextrin-Sodium Chloride Edible Coating. Heliyon 7 (2), e06279. 10.1016/j.heliyon.2021.e06279 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Moresco H. H., Queiroz G. S., Pizzolatti M. G., Brighente I. M. C. (2012). Chemical Constituents and Evaluation of the Toxic and Antioxidant Activities of Averrhoa carambola Leaves. Rev. Bras. Farmacogn. 22, 319–324. 10.1590/s0102-695×2011005000217 [CrossRef] [Google Scholar]
- Muhammed E., Chen L., Gao Y., Erenso D. (2019). Chemo-Treated 4T1 Breast Cancer Cells Radiation Response Measured by Single and Multiple Cell Ionization Using Infrared Laser Trap. Sci. Rep. 9 (1), 17547. 10.1038/s41598-019-53821-y [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Muthu N., Lee S. Y., Lee S. Y., Phua K. K., Bhore S. J. (2016). Nutritional, Medicinal and Toxicological Attributes of Star-Fruits (Averrhoa carambola L.): A Review. Bioinformation 12 (12), 420–424. 10.6026/97320630012420 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Pang D., You L., Li T., Zhou L., Sun-Waterhouse D., Liu R. H. (2016). Phenolic Profiles and Chemical- or Cell-Based Antioxidant Activities of Four Star Fruit (Averrhoa carambola) Cultivars. RSC Adv. 6, 90646–90653. 10.1039/c6ra15692d [CrossRef] [Google Scholar]
- Pang D., You L., Zhou L., Li T., Zheng B., Liu R. H. (2017). Averrhoa Carambolafree Phenolic Extract Ameliorates Nonalcoholic Hepatic Steatosis by Modulating mircoRNA-34a, mircoRNA-33 and AMPK Pathways in Leptin Receptor-Deficient db/db Mice. Food Funct. 8 (12), 4496–4507. 10.1039/c7fo00833c [PubMed] [CrossRef] [Google Scholar]
- Pham H. T., Huang W., Han C., Li J., Xie Q., Wei J., et al. (2017). Effects of Averrhoa carambola L. (Oxalidaceae) Juice Mediated on Hyperglycemia, Hyperlipidemia, and its Influence on Regulatory Protein Expression in the Injured Kidneys of Streptozotocin-Induced Diabetic Mice. Am. J. Transl. Res. 9 (1), 36–49. [PMC free article] [PubMed] [Google Scholar]
- Provesi J. G., Valentim Neto P. A., Arisi A. C. M., Amante E. R. (2019). Extraction of Antifreeze Proteins from Cold Acclimated Leaves of Drimys Angustifolia and Their Application to star Fruit (Averrhoa carambola) Freezing. Food Chem. 289, 65–73. 10.1016/j.foodchem.2019.03.055 [PubMed] [CrossRef] [Google Scholar]
- Qin L. H., Wu X. C., Zhou X., Wu Y. N., Huang R. B., Zhang S. J. (2019). Effects of Benzoquinone of Averrhoa carambola L. Root on Glucose and Lipid Metabolism, Oxidative Stress and Inflammatory Injury in Diabetic Mice. Chin. Pharmacol. Bull. 35 (12), 1720–1725. 10.3969/j.issn.1001-1978.2019.12.019 [CrossRef] [Google Scholar]
- Qin L., Zhang X., Zhou X., Wu X., Huang X., Chen M., et al. (2020). Protective Effect of Benzoquinone Isolated from the Roots of Averrhoa carambola L. on Streptozotocin-Induced Diabetic Mice by Inhibiting the TLR4/NF-κB Signaling Pathway. Diabetes Metab. Syndr. Obes. 13, 2129–2138. 10.2147/dmso.s241998 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ramadan N. S., Wessjohann L. A., Mocan A., C Vodnar D., H. El-Sayed N., A. El-Toumy S., et al. (2020). Nutrient and Sensory Metabolites Profiling of Averrhoa carambola L. (Starfruit) in the Context of its Origin and Ripening Stage by GC/MS and Chemometric Analysis. Molecules 25 (10), 2423. 10.3390/molecules25102423 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Rashid A. M., Lu K., Yip Y. M., Zhang D. (2016). Averrhoa carambola L. Peel Extract Suppresses Adipocyte Differentiation in 3T3-L1 Cells. Food Funct. 7 (2), 881–892. 10.1039/c5fo01208b [PubMed] [CrossRef] [Google Scholar]
- Robins Wahlin T.-B., Byrne G. J. (2011). Personality Changes in Alzheimer’s Disease: a Systematic Review. Int. J. Geriat. Psychiatry 26 (10), 1019–1029. 10.1002/gps.2655 [PubMed] [CrossRef] [Google Scholar]
- Ronpirin C., Pattarachotanant N., Tencomnao T. (2016). Protective Effect of Mangifera indica Linn., Cocos nucifera Linn., and Averrhoa carambola Linn. Extracts against Ultraviolet B-Induced Damage in Human Keratinocytes. Evid. Based Compl. Alternat. Med. 2016, 1684794. 10.1155/2016/1684794 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Rufino M. S. M., Alves R. E., Fernandes F. A. N., Brito E. S. (2011). Free Radical Scavenging Behavior of Ten Exotic Tropical Fruits Extracts. Food Res. Int. 44 (7), 2072–2075. 10.1016/j.foodres.2010.07.002 [CrossRef] [Google Scholar]
- Saghir S. A., Sadikun A., Al-Suede F. S., Majid A. M., Murugaiyah V. (2016). Antihyperlipidemic, Antioxidant and Cytotoxic Activities of Methanolic and Aqueous Extracts of Different Parts of Star Fruit. Curr. Pharm. Biotechnol. 17 (10), 915–925. 10.2174/1389201017666160603013434 [PubMed] [CrossRef] [Google Scholar]
- Saikia S., Mahnot N. K., Mahanta C. L. (2015). Optimisation of Phenolic Extraction from Averrhoa carambola Pomace by Response Surface Methodology and its Microencapsulation by spray and Freeze Drying. Food Chem. 171, 144–152. 10.1016/j.foodchem.2014.08.064 [PubMed] [CrossRef] [Google Scholar]
- Shui G., Leong L. P. (2004). Analysis of Polyphenolic Antioxidants in star Fruit Using Liquid Chromatography and Mass Spectrometry. J. Chromatogr. A 1022, 67–75. 10.1016/j.chroma.2003.09.055 [PubMed] [CrossRef] [Google Scholar]
- Shui G., Leong L. P. (2006). Residue from star Fruit as Valuable Source for Functional Food Ingredients and Antioxidant Nutraceuticals. Food Chem. 97, 277–284. 10.1016/j.foodchem.2005.03.048 [CrossRef] [Google Scholar]
- Siddika A., Zahan T., Khatun L., Habib M. R., Aziz M. A., Tareq A. R. M., et al. (2020). In Vivo the Antioxidative Extract of Averrhoa carambola Linn. Leaves Induced Apoptosis in Ehrilch Ascites Carcinoma by Modulating P53 Expression. Food Sci. Biotechnol. 29 (9), 1251–1260. 10.1007/s10068-020-00775-x [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Silva K. B., Pinheiro C. T. S., Soares C. R. M., Souza M. A., Matos-Rocha T. J., Fonseca S. A., et al. (2021). Phytochemical Characterization, Antioxidant Potential and Antimicrobial Activity of Averrhoa carambola L. (Oxalidaceae) against Multiresistant Pathogens. Braz. J. Biol. 81 (3), 509–515. 10.1590/1519-6984.220259 [PubMed] [CrossRef] [Google Scholar]
- Silva K. D. R. R., Sirasa M. S. F. (2018). Antioxidant Properties of Selected Fruit Cultivars Grown in Sri Lanka. Food Chem. 238, 203–208. 10.1016/j.foodchem.2016.08.102 [PubMed] [CrossRef] [Google Scholar]
- Singh R., Sharma J., Goyal P. K. (2014). Prophylactic Role of Averrhoa carambola (Star Fruit) Extract against Chemically Induced Hepatocellular Carcinoma in Swiss Albino Mice. Adv. Pharmacol. Sci. 2014, 158936. 10.1155/2014/158936 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Soncini R., Santiago M. B., Orlandi L., Moraes G. O. I., Peloso A. L. M., dos Santos M. H., et al. (2011). Hypotensive Effect of Aqueous Extract of Averrhoa carambola L. (Oxalidaceae) in Rats: an In Vivo and In Vitro Approach. J. Ethnopharmacol. 133 (2), 353–357. 10.1016/j.jep.2010.10.001 [PubMed] [CrossRef] [Google Scholar]
- Sritharan T., Savitri Kumar N., Jayasinghe L., Araya H., Fujimoto Y. (2019). Isocoumarins and Dihydroisocoumarins from the Endophytic Fungus Biscogniauxia capnodes Isolated from the Fruits of Averrhoa carambola . Nat. Product. Commun. 14, 1934578X1985196. 10.1177/1934578X19851969 [CrossRef] [Google Scholar]
- Tang J. Z., Nong H. L., Liang X. M., Huang J. C., Qin F. Z., Huang R. B. (2017). Effect of the Ethanol Extracts of Averrhoa carambola Root on Blood Pressure in Normal Rats. West. China J. Pharm. Sci. 32 (2), 160–162. 10.1016/j.biopha.2019.109612 [CrossRef] [Google Scholar]
- Teng H., Yuan B., Gothai S., Arulselvan P., Song X., Chen L. (2018). Dietary Triterpenes in the Treatment of Type 2 Diabetes: To Date. Trends Food Sci. Technol. 72, 34–44. 10.1016/j.tifs.2017.11.012 [CrossRef] [Google Scholar]
- Thomas R., Jebin N., Saha R., Sarma D. K. (2016). Antioxidant and Antimicrobial Effects of Kordoi (Averrhoa carambola) Fruit Juice and Bamboo (Bambusa polymorpha) Shoot Extract in Pork Nuggets. Food Chem. 190, 41–49. 10.1016/j.foodchem.2015.05.070 [PubMed] [CrossRef] [Google Scholar]
- Uuh-Narváez J. J., González-Tamayo M. A., Segura-Campos M. R. (2021). A Study on Nutritional and Functional Study Properties of Mayan Plant Foods as a New Proposal for Type 2 Diabetes Prevention. Food Chem. 341, 128247. 10.1016/j.foodchem.2020.128247 [PubMed] [CrossRef] [Google Scholar]
- Valim F. d. P., Aguiar-Oliveira E., Kamimura E. S., Alves V. D., Maldonado R. R. (2016). Production of Star Fruit Alcoholic Fermented Beverage. Indian J. Microbiol. 56 (4), 476–481. 10.1007/s12088-016-0601-9 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Varela-Martínez D. A., González-Curbelo M. Á., González-Sálamo J., Hernández-Borges J. (2019). High-Throughput Analysis of Pesticides in Minor Tropical Fruits from Colombia. Food Chem. 280, 221–230. 10.1016/j.foodchem.2018.12.045 [PubMed] [CrossRef] [Google Scholar]
- Vasant R. A., Narasimhacharya A. V. R. L. (2014). Antidotal Activity of Averrhoa carambola (Star Fruit) on Fluoride Induced Toxicity in Rats. Interdiscip. Toxicol. 7 (2), 103–110. 10.2478/intox-2014-0014 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Vasconcelos C. M. L., Araújo M. S., Conde-Garcia E. A. (2006). Electrophysiological Effects of the Aqueous Extract of Averrhoa carambola L. Leaves on the Guinea Pig Heart. Phytomedicine 13 (7), 501–508. 10.1016/j.phymed.2005.01.013 [PubMed] [CrossRef] [Google Scholar]
- Wakte S. R., Patil D. A. (2011). Antimicrobial and Antioxidant Activity of Averrhoa Carambola L. Fruit at Various Stages of Ripening. J. Herb. Med. Toxicol. 5 (2), 121–129. [Google Scholar]
- Wang Y., Liu M., Liu L., Xia J.-H., Du Y.-G., Sun J.-S. (2018). The Structural Revision and Total Synthesis of Carambolaflavone A. J. Org. Chem. 83 (7), 4111–4118. 10.1021/acs.joc.8b00008 [PubMed] [CrossRef] [Google Scholar]
- Wei S.-D., Chen H., Yan T., Lin Y.-M., Zhou H.-C. (2014). Identification of Antioxidant Components and Fatty Acid Profiles of the Leaves and Fruits from Averrhoa carambola . LWT – Food Sci. Technol. 55, 278–285. 10.1016/j.lwt.2013.08.013 [CrossRef] [Google Scholar]
- Wei X. J., Xu X. H., Chen Z. F., Liang T., Wen Q. W., Qin N., et al. (2018). Protective Effects of 2-Dodecyl-6-Methoxycyclohexa-2,5-Diene-1,4-Dione Isolated from Averrhoa carambola L. (Oxalidaceae) Roots on Neuron Apoptosis and Memory Deficits in Alzheimer’s Disease. Cell. Physiol. Biochem. 49 (3), 1064–1073. 10.1159/000493289 [PubMed] [CrossRef] [Google Scholar]
- Wen Q., Lin X., Liu Y., Xu X., Liang T., Zheng N., et al. (2012). Phenolic and Lignan Glycosides from the Butanol Extract of Averrhoa carambola L. Root. Molecules 17, 12330–12340. 10.3390/molecules171012330 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Wen Q. W., Chen C. X., Liang X. M., Xu X. H., Huang R. B. (2014). Isolation, Identification and Determination for Benzoquinone Compounds from Averrhoa carambola Root. Chin. J. Exp. Tradit. Med. Formulae 20 (11), 70–73. 10.13422/j.cnki.syfjx.2014110070 [CrossRef] [Google Scholar]
- Wen Q. W., Liang T., Qin F. Z., Wei J. B., He Q. L., Luo X., et al. (2013). Lyoniresinol 3α-O-β-D-Glucopyranoside-Mediated Hypoglycaemia and its Influence on Apoptosis-Regulatory Protein Expression in the Injured Kidneys of Streptozotocin-Induced Mice. PLoS One 8 (12), e81772. 10.1371/journal.pone.0081772 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Wijayaratne D. R., Bavanthan V., de Silva M. V. C., Nazar A. L. M., Wijewickrama E. S. (2018). Star Fruit Nephrotoxicity: a Case Series and Literature Review. BMC Nephrol. 19 (1), 288. 10.1186/s12882-018-1084-1 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- World Health Organization and Regional Office for the Western Pacific (2007). WHO International Standard Terminologies on Traditional Medicine in the Western Pacific Region. Manila: WHO Regional Office for the Western Pacific. [Google Scholar]
- Wu S. S., Sun W., Xu Z. C., Zhai J. W., Li X. P., Li C. R., et al. (2020b). The Genome Sequence of Star Fruit (Averrhoa carambola). Hortic. Res. 7, 95. 10.1038/s41438-020-0307-3 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Wu X. C., Lu S. Y., Zhou X., Qin L. H., Jiang L. H., Li Y. C., et al. (2020a). Anti-hepatocarcinoma Effect of and its Mechanism of 2-Dodecyl-6-Methoxycyclohexa-2,5-Diene-1,4-Dione in Averrhoa carambola L. Roots. Chin. J. Hosp. Pharm. 40 (1), 42–47. 10.13286/j.1001-5213.2020.01.05 [CrossRef] [Google Scholar]
- Xie Q., Zhang S., Chen C., Li J., Wei X., Xu X., et al. (2016). Protective Effect of 2-Dodecyl-6-Methoxycyclohexa-2, 5-Diene-1, 4-Dione, Isolated from Averrhoa carambola L., Against Palmitic Acid-Induced Inflammation and Apoptosis in Min6 Cells by Inhibiting the TLR4-MyD88-NF-κB Signaling Pathway. Cell. Physiol. Biochem. 39 (5), 1705–1715. 10.1159/000447871 [PubMed] [CrossRef] [Google Scholar]
- Xu X. H., Phama H. T. T., Wei X. J., Qin N., Huang R. B. (2017). Study of the Extract of Averrhoa carambola L. Root on Renal Function in Diabetic Mice and its Anti-Oxidative Action. Chin. Pharmacol. Bull. 33 (1), 95–100. 10.3969/j.issn.1001-1978.2017.01.017 [CrossRef] [Google Scholar]
- Xu X., Liang T., Lin X., Wen Q., Liang X., Li W., et al. (2015). Effect of the Total Extract of Averrhoacarambola (Oxalidaceae) Root on the Expression Levels of TLR4 and NF-κB in Streptozotocin-Induced Diabetic Mice. Cell. Physiol. Biochem. 36 (6), 2307–2316. 10.1159/000430194 [PubMed] [CrossRef] [Google Scholar]
- Xu X., Liang T., Wen Q., Lin X., Tang J., Zuo Q., et al. (2014). Protective Effects of Total Extracts of Averrhoa carambola L. (Oxalidaceae) Roots on Streptozotocin-Induced Diabetic Mice. Cell. Physiol. Biochem. 33 (5), 1272–1282. 10.1159/000358695 [PubMed] [CrossRef] [Google Scholar]
- Yang D.-P., Liu X., Teng C. P., Owh C., Win K. Y., Lin M., et al. (2017). Unexpected Formation of Gold Nanoflowers by a Green Synthesis Method as Agents for a Safe and Effective Photothermal Therapy. Nanoscale 9 (41), 15753–15759. 10.1039/c7nr06286a [PubMed] [CrossRef] [Google Scholar]
- Yang D., Jia X., Xie H. (2019b). Heptyl Vicianoside and Methyl Caramboside from Sour star Fruit. Nat. Product. Res. 33 (8), 1233–1236. 10.1080/14786419.2018.1466123 [PubMed] [CrossRef] [Google Scholar]
- Yang D., Jia X., Xie H., Wei X. (2016). Further Dihydrochalcone C-Glycosides from the Fruit of Averrhoa carambola . LWT – Food Sci. Technol. 65, 604–609. 10.1016/j.lwt.2015.08.061 [CrossRef] [Google Scholar]
- Yang D., Xie H., Jia X., Wei X. (2015). Flavonoid C-Glycosides from Star Fruit and Their Antioxidant Activity. J. Funct. Foods 16, 204–210. 10.1016/j.jff.2015.04.048 [CrossRef] [Google Scholar]
- Yang D., Xie H., Yang B., Wei X. (2014). Two Tetrahydroisoquinoline Alkaloids from the Fruit of Averrhoa carambola . Phytochem. Lett. 7, 217–220. 10.1016/j.phytol.2013.12.007 [CrossRef] [Google Scholar]
- Yang L., Zhu J., Song L., Shi X., Li X., Yu R. (2012). Three Sesquiterpene Compounds Biosynthesised from Artemisinic Acid Using Suspension-Cultured Cells of Averrhoa carambola (Oxalidaceae). Nat. Product. Res. 26 (15), 1388–1394. 10.1080/14786419.2011.589055 [PubMed] [CrossRef] [Google Scholar]
- Yang Y., Jia X., Xie H., Wei X. (2020a). Dihydrochalcone C-Glycosides from Averrhoa carambola Leaves. Phytochemistry 174, 112364. 10.1016/j.phytochem.2020.112364 [PubMed] [CrossRef] [Google Scholar]
- Yang Y. X., Huang T. M., Huang R. B., Xu X. H. (2018). Study on the Liver Tissue Anti-Oxidative Stress and Hypoglycemic Effects of Averrhoa carambola Fruit Juice. Food Sci. Dev. 39 (9), 148–151. 10.3969/j.issn.1005-6521.2018.09.028 [CrossRef] [Google Scholar]
- Yang Y. X., Huang T. M., Huang R. B., Xu X. H. (2019a). The Effects and Mechanism of Averrhoa carambola Fruit Juice on Blood Glucose in Diabetic Mice. J. Guangxi Med. Univ. 36 (1), 7–10. 10.16190/j.cnki.45-1211/r.2019.01.002 [CrossRef] [Google Scholar]
- Yang Y., Xie H., Jiang Y., Wei X. (2020b). Flavan-3-ols and 2-Diglycosyloxybenzoates from the Leaves of Averrhoa carambola . Fitoterapia 140, 104442. 10.1016/j.fitote.2019.104442 [PubMed] [CrossRef] [Google Scholar]
- Yao Q., Gao Y., Lai C., Wu C., Zhao C. L., Wu J. L., et al. (2020). The Phytochemistry, Pharmacology and Applications of Melicope pteleifolia: A Review. J. Ethnopharmacol. 251, 112546. 10.1016/j.jep.2020.112546 [PubMed] [CrossRef] [Google Scholar]
- Yasawardene P., Jayarajah U., De Zoysa I., Seneviratne S. L. (2020). Mechanisms of Star Fruit (Averrhoa carambola) Toxicity: A Mini-Review. Toxicon 187, 198–202. 10.1016/j.toxicon.2020.09.010 [PubMed] [CrossRef] [Google Scholar]
- Yasawardene P., Jayarajah U., De Zoysa I., Seneviratne S. L. (2021). Nephrotoxicity and Neurotoxicity Following Star Fruit (Averrhoa carambola) Ingestion: A Narrative Review. Trans. R. Soc. Trop. Med. Hyg. 10.1093/trstmh/trab026 [PubMed] [CrossRef] [Google Scholar]
- Zhang H., Lu S., Chen L., Huang X., Jiang L., Li Y., et al. (2020). 2-Dodecyl-6-Methoxycyclohexa-2,5-Diene-1,4-Dione, Isolated from the Root of Averrhoa carambola L., Protects against Diabetic Kidney Disease by Inhibiting TLR4/TGFβ Signaling Pathway. Int. Immunopharmacol. 80, 106120. 10.1016/j.intimp.2019.106120 [PubMed] [CrossRef] [Google Scholar]
- Zhang H., Wei X., Lu S., Lin X., Huang J., Chen L., et al. (2019). Protective Effect of DMDD, Isolated from the Root of Averrhoa carambola L., on High Glucose Induced EMT in HK-2 Cells by Inhibiting the TLR4-BAMBI-Smad2/3 Signaling Pathway. Biomed. Pharmacother. 113, 108705. 10.1016/j.biopha.2019.108705 [PubMed] [CrossRef] [Google Scholar]
- Zheng N., Lin X., Wen Q., Kintoko S., Zhang J., et al. (2013). Effect of 2-Dodecyl-6-Methoxycyclohexa-2,5-Diene-1,4-Dione, Isolated from Averrhoa carambola L. (Oxalidaceae) Roots, on Advanced Glycation End-Product-Mediated Renal Injury in Type 2 Diabetic KKAy Mice. Toxicol. Lett. 219 (1), 77–84. 10.1016/j.toxlet.2013.03.001 [PubMed] [CrossRef] [Google Scholar]
- Zheng N., Lin X., Wen Q., Kintoko S., Zhang J., et al. (2021). Effect of 2-Dodecyl-6-Methoxycyclohexa-2, 5-Diene-1, 4-Dione, Isolated from Averrhoa carambola L. (Oxalidaceae) Roots, on Advanced Glycation End-Product-Mediated Renal Injury in Type 2 Diabetic KKAy Mice. Toxicol. Lett. 339, 88–96. 10.1016/j.toxlet.2020.11.022 [PubMed] [CrossRef] [Google Scholar]
- Zhou X., Qin L. H., Wu X. C., Wu Y. N., Chen L. X., Huang R. B. (2019). Inhibition Effect of 2-Dodecyl-6-Methoxycyclohexa-2,5-Diene-1,4-Dione on Lung Cancer H1299 Cells. Chin. J. Clin. Pharmacol. 35 (21), 2675–2678. [Google Scholar]
- Zhu C., Xiao Y., Liu X., Han J., Zhang J., Wei L., et al. (2015). Pioglitazone Lowers Serum Retinol Binding Protein 4 by Suppressing its Expression in Adipose Tissue of Obese Rats. Cell. Physiol. Biochem. 35 (2), 778–788. 10.1159/000369737 [PubMed] [CrossRef] [Google Scholar]
- Zulfajri M., Dayalan S., Li W. Y., Chang C. J., Chang Y. P., Huang G. G. (2019). Nitrogen-Doped Carbon Dots from Averrhoa carambola Fruit Extract as a Fluorescent Probe for Methyl Orange. Sensors 19 (22), 5008. 10.3390/s19225008 [PMC free article] [PubMed] [CrossRef] [Google Scholar]