摘要
目的:本初步研究旨在评估健康老年人在饮用杨桃提取物前后的抗氧化状态和脂质状况,以及杨桃提取物中的维生素含量。
方法:在平均年龄(±SD)为69.5±5.3岁的27名老年人中实施一项初步设计的方案,计划在连续4周每日两次食用杨桃前设置2周对照期。分析氧化应激参数,如总抗氧化能力、谷胱甘肽、丙二醛、蛋白质过氧化氢,以及多种维生素如左旋抗坏血酸(维生素C)、视黄酸(维生素A)、生育酚(维生素E),以及血脂参数如胆固醇、甘油三酯、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)。此外,在为期4周的时间内对杨桃提取物中的维生素C、维生素A和维生素E水平进行评估。
结果:在2周对照期内,所有参数均未显示出统计学上的显著差异;连续4周食用后,观察到抗氧化状态显著改善,表现为总抗氧化能力增强、丙二醛和蛋白质过氧化氢水平降低,以及与基线期两次评估相比维生素C和维生素A水平显著升高。然而,谷胱甘肽和维生素E未显示出统计学差异。此外,HDL-C水平升高,而LDL-C水平显著低于两个基线期。但甘油三酯和胆固醇水平未见差异。在杨桃提取物中检测到少量的维生素C和维生素A。
结论:本初步研究表明,连续1个月每日两次饮用杨桃提取物可改善老年人的抗氧化状态和维生素水平,同时提升与杨桃提取物中维生素C和维生素A相关的脂蛋白水平。
关键词:杨桃、老年人、抗氧化剂、维生素、脂质、氧化应激
1.引言
全球范围内,无论是发达国家还是发展中国家,老龄化人口增长速度迅猛,预计泰国老龄人口将从2015年的900万增长至2035年的1590万。此外,大量证据表明,慢性疾病(如高血压、中风、心脏疾病、2型糖尿病和癌症)的患病率也在不断攀升。更有观点认为,衰老过程与氧化应激密切相关,甚至可能是由后者引发的。氧化应激与老年人群中诸多慢性疾病有着密切关联。对老年人群开展的研究表明,抗氧化剂如谷胱甘肽(GSH)浓度偏低或脂质及蛋白质结构氧化增多会导致氧化应激标志物如丙二醛(MDA)和蛋白质过氧化氢(PrOOH)水平上升。氧化剂生成增加与抗氧化缓冲能力减弱是肌少症的主要成因。因此,持续的氧化应激状态可能导致肌肉力量、耐力和功能能力下降。氧化应激在高血压病生理机制中发挥着重要作用,先前的一项综述报告指出,高血压与异常脂蛋白代谢(包括高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)水平低下)之间存在显著关联。此外,衰老会改变HDL组成,使其中的补体C3和急性期血清淀粉样蛋白水平升高,这些成分在老年人HDL的内肽酶/蛋白酶抑制中发挥作用。已有研究表明,HDL具有促进胆固醇排泄、抑制自由基氧化LDL分子的能力。有趣的是,已有建议提出,抑制LDL氧化与减少巨噬细胞释放促炎介质有关,这可降低内皮细胞上粘附分子表达,同时刺激一氧化氮(NO)形成,促进体内血管舒张。因此,氧化应激似乎与炎症过程、脂蛋白代谢,以及衰老过程中的物理功能相关。
目前,针对老年人的功能性食品如葡萄皮、牛奶、红绿椒、大蒜、洋葱、蔬菜和果汁等,被认为可减轻氧化应激,有可能延缓慢性疾病的进展。这些食品中的生物活性化合物,包括花青素、钙、番茄红素、姜黄素、α-生育酚(维生素E)、泛醌和抗坏血酸(维生素C),均与降低涉及脂蛋白代谢的氧化应激有关。
杨桃(Averrhoa carambola L.)是泰国及许多其他亚洲国家广泛种植的本土水果之一。切开后呈五角星形状,是其典型特征。杨桃皮呈绿色至黄绿色,果肉口感从鲜酸至微甜不等。已有资料记载其在人类中的多种传统应用,如降血压、增进食欲、退热、通便、利尿、助消化,以及治疗咽喉炎、口腔溃疡、牙痛、咳嗽、哮喘或眼部问题。此外,最新的综述显示了其化学成分和营养价值的有趣证据,包括传统用途。杨桃富含维生素C、表儿茶素和没食子酸,以及具有强抗氧化活性的黄酮类C-糖苷。先前研究显示,维生素C可在衰老过程中降低蛋白质糖基化和糖化血红蛋白,以及减少自由基引起的红细胞渗透脆性。因此,维生素C具有强大的抗氧化能力,而杨桃则是这种强效抗氧化剂的丰富、本地来源。然而,杨桃并不像西瓜、香蕉、番石榴和橙子等其他水果那样受欢迎,消费量也不大。此外,Leelarungrayub等人更新了他们关于让老年人每天两次补充杨桃提取物一个月的初步研究,结果显示显著抑制了肿瘤坏死因子-α和白介素-23等促炎细胞因子的释放,并提高了行走距离。然而,以往研究并未调查杨桃中的活性化合物,也没有探讨杨桃对老年人脂质谱的影响。因此,本初步研究旨在识别杨桃中的抗氧化化合物,并评估老年人食用杨桃后抗氧化状态和脂质谱的变化。
2.方法
2.1实验设计
实验设计分为两部分。在第一部分中,确定了老年人每日两次连续1个月食用杨桃提取物的效果。健康老年受试者被纳入研究方案,方案包含2周基线期,在此期间参与者维持正常饮食与日常活动,不摄入杨桃提取物;之后进入为期4周的干预期,期间在日常饮食中加入杨桃提取物。研究使用的杨桃均采自清迈府当地农户,确保每次消费前两周内收获的新鲜杨桃。因此,为满足4周实验期间的需求,共为老年受试者准备了四批收获的杨桃。每100克新鲜清洁杨桃通过搅拌机充分匀浆制备成提取物,于研究期间每日早餐和晚餐后立即饮用。在2周对照期和杨桃提取物饮用4周后的两个时间点,分别进行了基础全血计数(CBC)、肝功能(天冬氨酸转氨酶[AST]、丙氨酸转氨酶[ALT])、肾功能(血尿素氮[BUN]、肌酐)以及抗氧化状态(总抗氧化能力[TAC]、GSH、PrOOH和MDA)检测,同时测定维生素A、维生素E和维生素C水平。第二部分中,在4周饮用期内,每周一和周五随机选取十份新鲜杨桃样本,对其所含的维生素C、维生素A和维生素E进行实验室分析。
2.2参与者招募
本研究方案经泰国清迈大学联合医学科学学院人类伦理委员会批准,并按照赫尔辛基宣言(2001年版)(伦理批准编号:027E/52)执行。样本量通过G*Power(3.1.9.2)程序计算得出,效应量=0.92,α错误=0.05,功效=0.95,数据来源于先前研究。20本研究至少需要24名老年受试者。为了提高研究效能,我们纳入了来自清迈府Piyaman老年人保健中心的40名健康老年人(20名男性和20名女性),年龄在54岁至87岁之间,其中25人为非吸烟者,15人为戒烟5年的前吸烟者。尽管本研究最初共有40名健康老年参与者,但在为期6周的研究过程中,有13人因腹泻(n=3)、失访(n=3)和补充剂补充不连续或每周丢失超过两次(n=7)(无任何健康问题)选择退出。因此,剩余27人完成了研究。他们在参与研究前理解了研究方案并提供了书面同意。所有参与者通过查阅既往住院记录(如食管反流、咯血、肋骨骨折、凝血障碍、心律失常、任何肺部或神经系统疾病等)进行了排除标准筛查,并由泰国清迈大学联合医学科学学院AMS临床服务中心的医生确认。在为期6周的实验期间,他们都严格控制了自己的基本日常活动、行为表现和饮食摄入。他们被要求避免服用额外的复合维生素或食物补充剂。
2.3血液样本制备
从肘前静脉抽取的总计20毫升血液中,15毫升转移至无菌乙二胺四乙酸(EDTA)和非EDTA管中,用于全自动Olympus AU400分析仪(Olympus Diagnostics GmbH,德国Umkirch)在AMS临床服务中心评估全血计数、血脂、肝肾功能。剩余5毫升用于评估所有氧化应激标志物和血浆中维生素A、维生素E和维生素C。
2.4氧化应激与维生素评估
取400微升全血用于评估谷胱甘肽(GSH)。剩余血浆通过6000转/分钟离心10分钟分离,并立即测定总抗氧化能力(TAC)。剩余血浆被分离以测定丙二醛(MDA)、蛋白质过氧化氢(PrOOH)、维生素C、维生素A和维生素E。GSH浓度通过遵循Leelarungrayub等人先前的分光光度法协议计算,方法是将其吸光度与标准GSH(Sigma-Aldrich Co.,美国圣路易斯,MO)进行比较,最后以全血计数分析中每克血红蛋白(mg/g Hb)表示。
新鲜血浆的TAC采用2,2′-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid脱色法,通过分光光度法测定。TAC以每升标准Trolox毫摩尔(mmol Trolox/L)表示。
血浆中来自脂质氧化的MDA按照先前的高效液相色谱(HPLC)方法进行评估,该方法在硫代巴比妥酸反应物质试验下进行。血浆MDA(µmol/L)通过与标准四甲氧基丙烷(Sigma-Aldrich Co.)比较计算。
血浆PrOOH采用先前的铁氧化二甲苯酚橙协议评估。PrOOH(µmol/L)通过560纳米波长分光光度法测定,并与标准叔丁基过氧化氢(Sigma-Aldrich Co.)产量比较。
2.5血浆中抗氧化维生素评估
维生素A、维生素E和维生素C按照Talwar等人和Furusawa先前的HPLC协议进行评估。
在该协议中,血浆中维生素C在添加含有1毫摩尔EDTA的60%乙醇沉淀后进行评估,而维生素E和维生素A在用己烷萃取血浆后进行评估。然后,向样本中分别添加外部标准维生素C(100 µg/mL)和维生素E或维生素A(50 mg/L)。所有维生素在HPLC中分析,使用C-18反相柱(250×4.6×5.0 mm;Phenomenex,德国Aschaffenburg),并使用不同的流动相:维生素C为2%(v/v)醋酸水溶液(pH 2.5),维生素E和维生素A为甲醇-乙腈和四氢呋喃(75:20:5,v:v:v)混合物,流速分别为1.0和1.2毫升/分钟。维生素C、维生素E和维生素A的峰分别通过与标准抗坏血酸、醋酸生育酚和视黄酸(Sigma-Aldrich Co.)比较,在245、325和294纳米处单独识别。
2.6杨桃提取物中维生素分析
每周的周一和周五,从提供给老年受试者的准备好的杨桃材料中随机抽取十个果汁样品(每个样品100克,使用搅拌机精细匀浆制备)。样品以干粉提取物形式进行分析,采用冷冻干燥或冻干技术(维生素C、维生素A、维生素E)配合HPLC协议。25,26杨桃提取物中的维生素C在溶解于蒸馏水后进行分析,而维生素E或维生素A则用己烷(1:1/w:v)和氯仿(1:1/v:v)进行提取。样品处理完毕后,用于分析杨桃提取物的HPLC协议与用于分析人体血浆的相同。
2.7统计分析
本研究中所有数据均以平均值和标准差形式呈现,先通过Kolmogorov-Smirnov检验评估数据的正态分布。全血计数、肝肾功能、氧化应激及三次评估的维生素参数采用重复测量方差分析(ANOVA)及Bonferroni事后检验,使用SPSS软件包(版本10.0,SPSS Inc., 芝加哥,IL, USA)。统计显著性设定为P=0.05。此外,使用G*Power(3.1.9.2)计算本研究中氧化应激、维生素及血脂参数结果的有效性大小。
3.结果
总体结果显示,经过Kolmogorov-Smirnov检验统计分析后呈现出正态分布,因此以平均值和标准差形式展示。虽然纳入的老年人样本量较小(N=27),但重复测量方差分析仍是一种可行的统计测试。研究结果来自27名参与者,其中包括19名男性和8名女性,平均年龄为69.5±5.3岁。对照期和摄入期后的全血计数和肝肾功能测试结果无统计学差异,重复测量方差分析P值为0.05(表1)。
3.1氧化应激状态
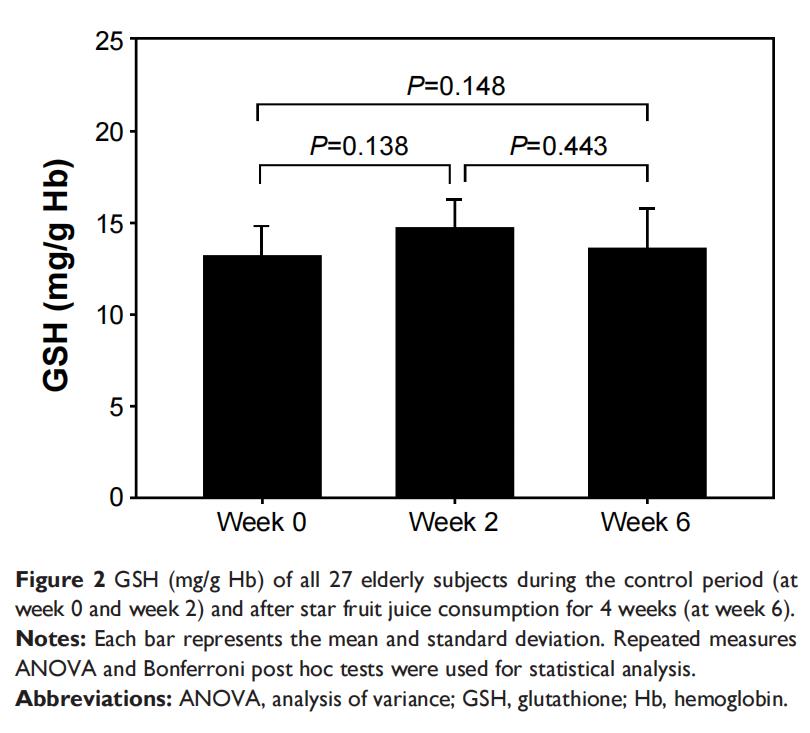
表2和图1-4展示了27名参与者氧化应激状态,对照期第0周和第2周的TAC、GSH、MDA和PrOOH之间未发现显著差异(P>0.05)。连续4周饮用杨桃提取物后,与第0周和第2周相比,一些氧化应激参数结果显示出显著改善(TAC、MDA、PrOOH的P<0.05),但GSH除外(P>0.05)。

3.2血浆中抗氧化维生素
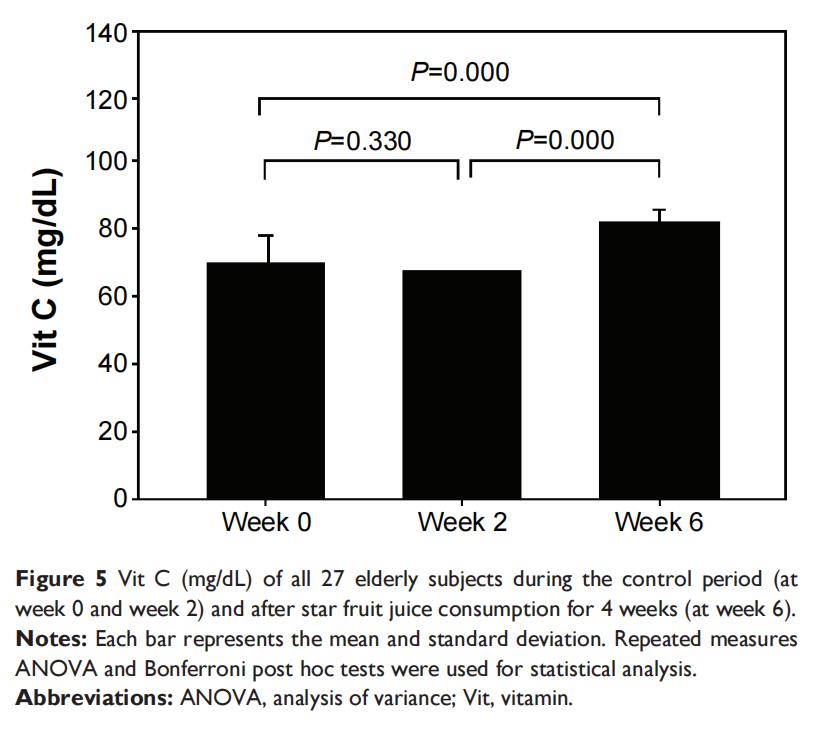
在2周基线期内,血浆中维生素C、维生素A或维生素E浓度无显著差异。表2和图5-7所示结果显示,在对照期内,所有27名老年受试者中维生素C、维生素A和维生素E水平均无统计学显著差异(P>0.05)。连续4周饮用杨桃提取物后,与对照期第0周和第2周相比,维生素C和维生素A水平显著升高(P<0.05),但维生素E水平未见显著变化(P>0.05)。
3.3血浆脂质谱
从表2所示脂质谱结果可以看出,包括甘油三酯、胆固醇、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)在内的所有参数,在对照期第0周与第2周之间并无统计学差异(P=0.68、0.79、0.83、0.55)。连续4周饮用杨桃提取物后,HDL-C水平显著升高(P=0.03和0.04),LDL-C水平显著降低(P=0.02和0.03),而与对照期第0周和第2周相比,甘油三酯(P=0.87和0.65)或胆固醇(P=0.52和0.71)水平未观察到统计学上显著变化。
3.4杨桃提取物中维生素
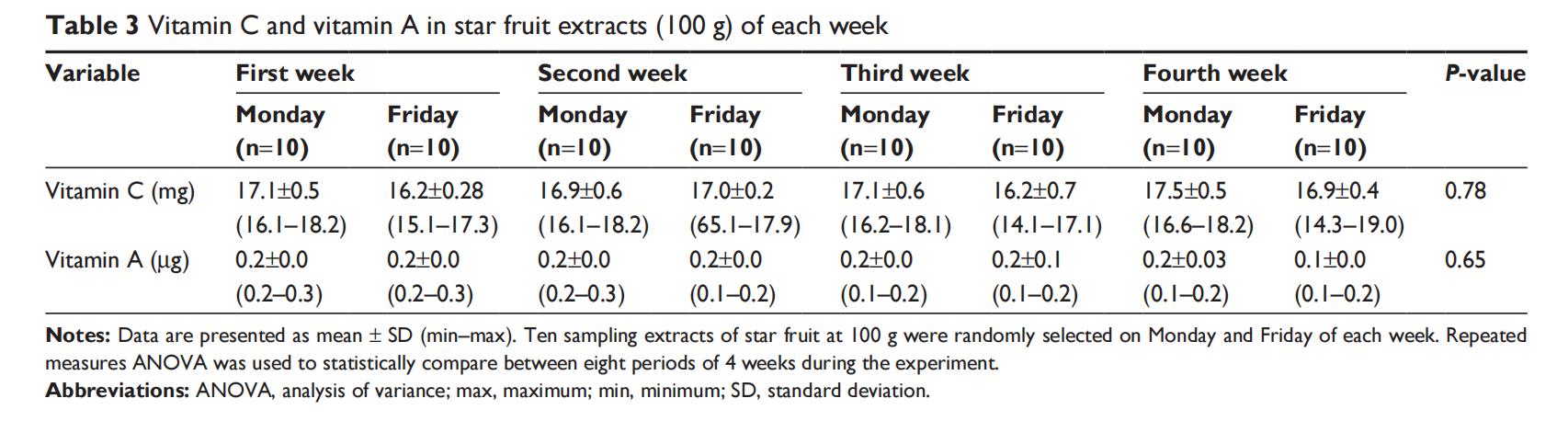
本研究中,根据先前的协议25,26可以评估维生素A和维生素C水平,而维生素E水平无法检测。4周摄入期间,通过HPLC评估杨桃提取物中维生素含量的结果显示,维生素C和维生素A浓度无显著差异(P>0.05),平均而言,维生素C和维生素A浓度分别约为17毫克和0.19微克(表3)。
4.讨论
先前有关杨桃提取物摄入的研究显示其对老年人的炎症反应和功能能力具有积极益处。此外,关于杨桃提取物摄入的抗炎、镇痛、降糖、驱虫、抗溃疡、降压、抗菌和抗氧化药理活性益处也有报道。然而,关于老年人摄入杨桃提取物的益处的科学证据并不多。因此,本初步研究的结果可能支持先前研究的结果,特别是在氧化应激和脂质谱方面。尽管本研究方案设计未包含正式对照组,但我们的数据对于此类初步调查是合适的。
本研究基线时MDA水平(3.35±0.56和3.55±0.67 µmol/L)(图3)与先前报道一致,表明这些参与者(平均年龄69.5±5.3岁)在对照期存在轻微的氧化状态升高。Mutlu-Turkoglu等人也有类似结果,他们发现30名健康老年人(平均年龄72.7±5.8岁)的MDA水平(3.96±1.12 µmol/L)高于25名年轻参与者(平均年龄30.0±4.6岁)的水平(2.55±0.75 µmol/L)。这与Mezzetti等人先前报告一致,他们认为老年人血浆过氧化物或MDA水平高于年轻队列。
此外,本研究结果显示血浆中维生素A(0.3±0.1和0.3±0.2 µg/mL)、维生素C(1.2±0.3和1.3±0.2 µg/mL)和维生素E(1.2±0.3 µg/mL)的基线水平,与先前一项针对低收入女性(维生素A 1.4±1.3 µmol/L,维生素E 2.1±1.1 µg/mL)和男性(维生素A 1.4±1.8 µmol/L,维生素E 2.0±1.1 µg/mL)的研究结果相似。
杨桃是众多具有抗氧化特性的水果之一,含有多种生物活性化合物,如总酚、维生素C和维生素A。此外,更新的杨桃营养成分也显示对人体健康有益,如抗炎和抗氧化作用。关于富含维生素植物或功能性食品抗氧化活性的重要研究已显示维生素A和维生素C均可清除自由基和过氧化氢(H2O2)。本研究评估了在摄入期间每周周一和周五选择的杨桃提取物中维生素A、维生素C和维生素E水平(表3)。HPLC结果显示,老年人摄入后血浆中维生素C和维生素A水平有显著变化(表2),证实了先前研究结果。Lim的研究还显示,杨桃的TAC(131±54 mg/100 g)、抗坏血酸(5.2±1.9 mg/100 g)和相当于抗氧化能力的抗坏血酸当量(98±55 mg/100 g)均显著高于橙子(75±10、67±9和31±10 mg/100 g)和山竹(54±7、5.8±0.8和32.3±10.3 mg/100 g)。
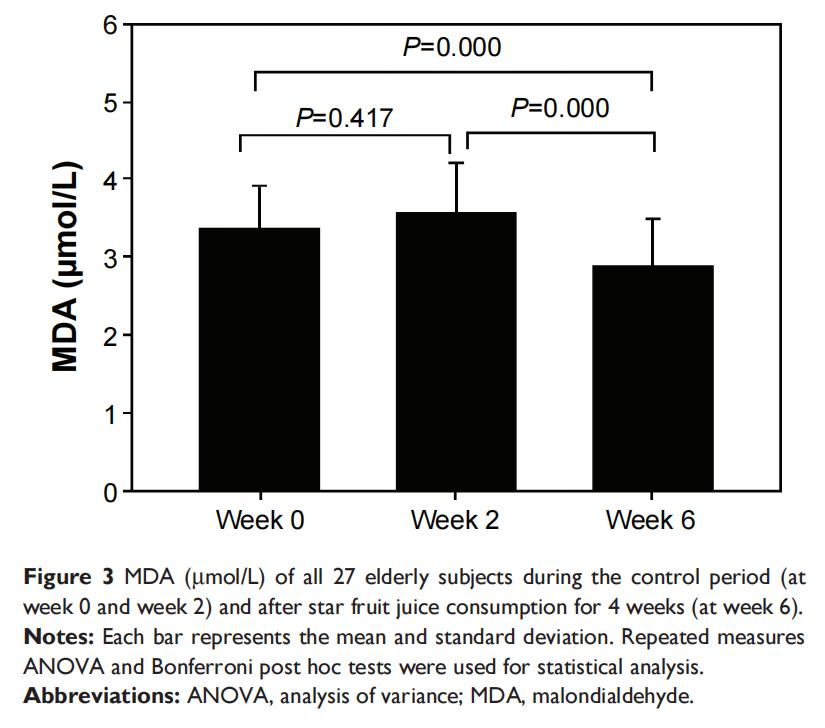
表2中获得的老年人数据(表2)显示,通过显著增加TAC(图1)以及降低MDA(图3)和PrOOH(图4)水平,摄入杨桃提取物具有有益效果。水果中的抗氧化剂可能改变氧化应激水平(图5和6)。然而,GSH和维生素E水平在对照期和摄入后均未发生变化,这可能是由于杨桃中维生素E浓度较低所致。GSH、维生素C、维生素A和维生素E是保护生物系统免受氧化应激损害的抗氧化化合物,可通过TAC标记物进行评估。因此,TAC水平显著增加可能是由于维生素A和维生素E水平增加。
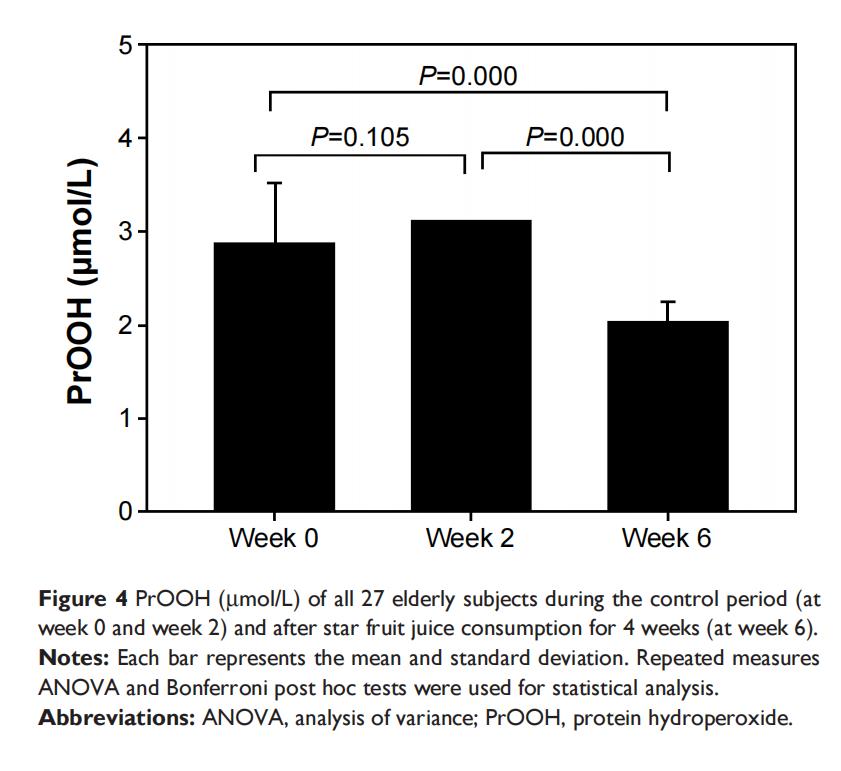
表2中呈现的有趣脂质谱结果显示,HDL-C和LDL-C水平分别显著升高和降低,而胆固醇和甘油三酯没有显著变化。然而,Chau等人在先前对仓鼠的研究中报告,从杨桃果渣中分离出的水不溶性、富含纤维的部分具有降胆固醇和降脂活性。本初步研究中HDL-C和LDL-C的变化与整体健康有关,考虑到先前有报告提出氧化应激可诱发高血压和异常脂蛋白代谢。此外,一些报告显示,HDL可通过促进胆固醇外排、抑制LDL氧化和减少粘附分子表达等多种机制抑制炎症过程。老年人摄入杨桃提取物后HDL升高可能有助于解释为什么先前初步研究发现肿瘤坏死因子-α和白介素-23等促炎细胞因子显著降低。此外,老年人血液中抗氧化状态的结果可用于解释为何本研究和先前研究中NO水平显著降低。与之相反,先前一项关于老年人摄入杨桃提取物的初步研究报道了步行距离显著增加,但NO水平显著下降。
本研究结果可能可以用Neville等人在39名老年人中证实的机制来解释,他们发现摄入水果或蔬菜后,抗坏血酸与握力状况呈正相关。但一些证据仍争议地证实了维生素C补充剂量和时间与肌肉力量的关系。
本初步研究的整体结果表明,老年人每天两次摄入100克杨桃提取物持续1个月,可能通过其抗氧化活性以及对HDL-C和LDL-C等脂蛋白的调控带来益处。为此,本研究遵循临床试验申请指南,在实验期间对全血计数(CBC)、肝功能试验(如AST和ALT)和肾功能试验(如BUN和肌酐水平)进行了评估。杨桃中的草酸盐可能影响红细胞、血红蛋白和血细胞比容,导致溶血性贫血,以及可能对白细胞和血小板产生抑制作用,从而影响免疫系统。如果肝脏——所有化学化合物的主要解毒器官——受损,肝细胞酶如AST和ALT会被释放并在血液中以高浓度检测到。最后,BUN和肌酐是肾功能障碍的临床标志物,如肾梗阻或损伤。如果这些值在研究开始时升高,则受试者将被排除。同样,如果在摄入杨桃4周后这些值升高,这可能提示补充剂存在潜在不良反应。
先前证据表明,对肾功能的不良影响可能值得关注,特别是对于患有尿毒症或慢性肾脏疾病的患者。然而,本研究中27名老年人的结果显示,三次实验中BUN和肌酐水平均在参考范围内,无统计学差异(表1)。因此,本研究中的摄入方案对健康老年人是安全的。然而,本研究未评估草酸盐水平,这应被视为本研究的局限性。因此,未来需要谨慎并保持警惕。在本研究结束时,可以认为应进一步开发和研究杨桃作为功能性水果的应用,包括安全剂量和在人体中的可用给药方法;同时,还应评估其他具有强抗氧化潜力的抗氧化化合物,如单宁、皂苷、生物碱、表儿茶素、没食子酸和黄酮类C-葡萄糖苷在老年人中的应用。
5.结论与局限性
本初步研究表明,27名平均年龄为69.5±5.3岁的健康老年人在清迈府老年人保健中心摄入含有抗坏血酸(维生素C)和视黄酸(维生素A)的100克杨桃提取物后,降低了氧化应激,表现为减少脂质氧化、改善抗氧化状态,同时增加了血中HDL-C水平、降低了LDL-C水平。尽管本研究样本量较小,但每项结果的效果量也通过G*Power分析得到确认,并在表2中表示。鉴于先前报告强烈建议在样本量较小的情况下P值可能不够标准化,需要计算Cohen’s d(效应量)。Cohen将效应量分为小(d=0.2)、中(d=0.5)和大(d≥0.8)三类。因此,具有大效应量的显著结果被认为更为稳健。值得注意的是,表2中所示各项参数的显著值均与大或高的效应量相关,例如TAC(2.28)、MDA(1.07)、PrOOH(2.88)、维生素C(2.48)、HDL-C(1.22)和LDL-C(1.05),唯独维生素A(0.68)除外。因此,维生素A的结果仍需未来更大样本量的研究加以确认。未来研究应旨在纳入更大样本量,并关注不同性别及全球各地老年人群的结果,这可能为未来更广泛使用杨桃提供依据。
6.致谢
本研究由泰国研究基金(TRF)(RDG5220040)资助。作者衷心感谢泰国研究基金(TRF)以及所有参与研究的老年人,以及协助并组织整个研究的护理人员。
7.作者贡献
JL负责获取资金、设计研究、建立所有协议、进行实验室检测和数据分析。JJL、RJB和RP提供了关键评论,复查了语法,并协助进行了初稿编辑。与AY和DP一起,他们还协助复查了原始稿件和最终稿件版本。所有作者阅读并批准了最终版本。所有作者对数据分析、论文起草和修订做出了贡献,并对论文的所有方面承担责任。
8.参考文献
