摘要
我们之前的研究已经表明,杨桃(Averrhoa carambola L.)是天然抗氧化剂的良好来源,多酚为其主要抗氧化成分。本研究发现,在果汁饮料加工过程中通常被丢弃的杨桃残渣,其抗氧化活性明显高于用多种方法评估抗氧化活性时所得到的榨取果汁。在优化的提取条件下,残渣约占总抗氧化活性(TAA)和总多酚含量的70%,但仅占整果重量的15%。占总重量约5%的冻干残渣粉,其总多酚含量为33.2 ± 3.6 mg没食子酸当量(GAE)/g样品,总抗氧化活性分别为3490 ± 310和3412 ± 290 mg L-抗坏血酸当量抗氧化能力(AEAC)或5270 ± 468和5152 ± 706 mg Trolox当量抗氧化能力(TEAC)/100 g样品,分别通过2,20-azine-bis-(3-ethylbenzthiazoline-6-sulfonic acid)自由基(ABTS⁺)和1,1-二苯基-2-苦基肼(DPPH⁺)清除试验测定。同时,每克样品还测得510.3 ± 68.1 mol铁还原/抗氧化能力(FRAP)。残渣提取物在110℃下延缓大豆油氧化酸败方面也显示出强烈的抗氧化活性。与标准化原花青素提取物相比,残渣提取物的抗氧化活性和多酚谱有显著差异。残渣提取物中高含量的多酚及其强抗氧化活性表明,残渣粉在功能性食品中使用时可能带来健康益处,残渣提取物在未来也应被视为潜在的营养补充资源。
关键词:杨桃; 抗氧化剂; 抗酸败; 酚醛树脂; 残留物; 功能性食品; 营养保健品
1. 引言
水果和蔬菜是预防退行性疾病的良好天然抗氧化剂膳食来源。水果或蔬菜抗氧化能力的主要贡献很可能来自除维生素C以外的各种植物化学物质(Leong & Shui, 2002)。水果和蔬菜含有许多抗氧化剂,如多酚、硫醇、类胡萝卜素和生育酚,它们可能保护我们免受慢性疾病的侵害。抗氧化剂可以通过调节活性自由基来减少对生物分子的氧化损伤。因此,建议增加水果和蔬菜的摄入量。对于营养补充剂和功能性食品日益增长的市场需求,已经引发了对天然抗氧化剂来源及其作为营养补充剂和功能性食品潜力的研究(Cevallos-Casals & Cisneros-Zevallos, 2003; Lachance, 2002; Lachance, Nakat, & Jeong, 2001)。为了防止营养流失,通常鼓励食用新鲜的水果和蔬菜。然而,出于运输、延长保质期等目的,它们也被加工成果汁和果汁饮料。在果汁或果汁饮料的加工过程中,很可能会产生农业和工业废物,这些废物很可能被丢弃或仅用作低价值副产品。正如之前所回顾的那样,可以从这些剩余来源中提取出许多抗氧化剂(Moure等人,2001)。最近,苹果皮被报道为一种用于促进健康的附加值食品成分,因为它含有植物化学成分(Wolfe & Liu, 2003; Wolfe, Wu, & Liu, 2003)。八种不同油籽油提取物的残渣被报道含有酚类化合物,显示出显著的抗氧化活性,可用于保护脂肪和油(Matthaus, 2002)。
杨桃生长在热带和亚热带地区。这是一种相当受欢迎的水果,在东南亚和许多其他国家广泛种植。通常食用新鲜杨桃,或制成露酒或果汁饮料。我们已经报道,杨桃是天然抗氧化剂的良好来源,杨桃中的抗氧化剂是原花青素、表儿茶素和维生素C(Leong & Shui, 2002; Shui & Leong, 2004)。当杨桃被用来生产果汁饮料时,通常只使用果汁,而残渣常常被丢弃或用于生产低价值副产品。本研究的目的进一步调查残渣的抗氧化能力和总多酚贡献。此外,我们还将探讨将来利用残渣作为有价值的食品成分或营养补充产品资源的可能性。
2. 材料与方法
2.1. 化学品与试剂
2,20-偶氮二(3-乙基苯并噻唑啉-6-磺酸)(ABTS)、1,1-二苯基-2-苦基肼、表儿茶素和过硫酸钾购自Sigma公司(美国密苏里州);无水碳酸钠和(+)-儿茶素水合物购自Chem. Aldrich公司(美国威斯康辛州);Trolox、没食子酸和三吡啶三嗪(TPTZ)购自Acros Organics公司(美国新泽西州);Folin-Ciocalteu试剂、氯化铁、硫酸亚铁购自Merck公司(德国达姆施塔特)。
2.2. 样品制备与提取
从当地超市或批发中心购买了几批杨桃。从新加坡Guardian药店分店购买了一款由Nuvanta公司生产的商业Pycnogenol产品,原料来自法国滨海松树皮。市场上购买的新鲜杨桃使用搅拌机匀浆,离心并真空过滤。液体部分(果汁)直接用于抗氧化能力与总多酚含量测定。固体部分(残渣)经冷冻干燥成粉末,约占总重量的5%。采用不同比例的溶剂(丙酮或乙醇):水(分别为0%、30%、50%、70%和100%),以获取合适的提取溶剂及溶剂与水的比例。采用配对样本t检验来确定两种溶剂之间是否存在显著差异。在选定的提取溶剂下,比较了不同的提取温度(30℃、50℃、70℃和90℃)。在选定的溶剂和温度下,应用不同的提取时间(15分钟、30分钟、45分钟和60分钟),以获得合适的提取时间。提取在密封玻璃瓶中进行,将其置于预设温度的水浴中。通过测量各个提取物的总抗氧化活性(TAA),比较不同提取模块的提取效率。采用ABTS⁺脱色法测定杨桃的TAA。对残渣进行三次提取,以考察多次提取的必要性。第一次提取残渣(w/v,1:60)在最佳提取条件下获得。第二次和第三次提取在相似提取条件下进行,但保留提取时间减少至15分钟。三次提取物合并后,在40℃真空下蒸发除去溶剂,然后重新溶解于水中。还测试了三个单独提取物的抗氧化活性,用于比较提取效率。残渣提取物经过0.5μm膜过滤后,直接用于HPLC和HPLC/MS检测。还对果汁和提取物的抗氧化能力进行了检测。
商用Pycnogenol片剂研磨成粉末,与50%水相乙醇在暗瓶中混匀2小时。提取物离心并用滤纸(Whatman 1号)过滤。滤液通过真空蒸发干燥,再溶解于20%水相甲醇中。所得溶液经0.5μm膜过滤后,用于HPLC/MS检测。还对溶液的抗氧化活性进行了测试。
2.3. ABTS⁺清除法测定总抗氧化活性(TAA)
在Ultraspec 3000 UV/可见光分光光度计(Pharmacia Biotech Ltd., 英国剑桥 CB4 4FJ)上进行TAA测定。按照Leong & Shui(2002)所述进行操作。简而言之,通过将ABTS(7.4mM)与过硫酸钾(2.6mM)反应生成ABTS⁺。在使用前,将该溶液稀释至pH 4.5盐酸溶液中,使其在414nm处吸光度为1.5-2.0U。向3ml此溶液中加入20-80μl提取物或L-抗坏血酸溶液。1小时后记录414nm处吸光度的变化。通过比较含提取物的测试反应混合液与含L-抗坏血酸和Trolox的测试反应混合液在414nm处吸光度变化,得到提取物的抗氧化能力,以每100g样品mg L-抗坏血酸当量抗氧化能力(AEAC)和Trolox当量抗氧化能力(TEAC)表示。
2.4. DPPH⁺清除法测定TAA
采用Brand-Williams、Cuvelier和Berset(1995)所述方法测定果实的DPPH⁺清除能力。配制0.1mM DPPH(1,1-二苯基-2-苦基肼)在甲醇中的溶液。向3ml此溶液中加入10-40μl L-抗坏血酸或果蔬提取物。混合后每隔5分钟测定517nm处吸光度,直至反应达到平台期。计算吸光度损失,并以mg L-抗坏血酸当量抗氧化能力(AEAC)和Trolox当量抗氧化能力(TEAC)表示。
2.5. FRAP法测定TAA
采用Benzie和Strain(1999)所描述的FRAP法(铁还原/抗氧化能力)的修改版测定植物提取物的抗氧化能力。FRAP试剂包含2.5ml 10mM三吡啶三嗪(TPTZ)在40mM盐酸中的溶液,加上2.5ml 20mM FeCl3·6H2O和25ml pH 3.6的0.3M醋酸缓冲液。简而言之,将3.0ml新鲜制备并加热至37℃的FRAP试剂与40μl植物提取物混合,反应混合物在37℃孵育。以含蒸馏水的试剂空白作为对照,其也在37℃孵育长达1小时(而非FRAP法原采用的4分钟),在593nm处测定吸光度。使用浓度范围为100-2000μM(FeSO4·7H2O)的已知Fe(II)水溶液进行校准。
2.6. Folin-Ciocalteu法测定总多酚含量
采用Folin-Ciocalteu试剂(Singleton & Rossi, 1965)测定总多酚。配制2.0mg/mL的没食子酸标准溶液,精确称取0.01g,溶于50ml蒸馏水中。然后将溶液稀释,得到浓度为1.5、1.0、0.5、0.2和0.1mg/mL的工作标准溶液。将40μl果汁/残渣提取物或没食子酸标准与1.8ml Folin-Ciocalteu试剂(预先用蒸馏水稀释10倍)混合,室温下静置5分钟,然后加入1.2ml碳酸氢钠(7.5%)。室温下静置60分钟后,在765nm处测定吸光度。结果以mg/g没食子酸当量(GAE)表示。
2.7. 残渣提取物对大豆油的抗氧化性能
取0.2g残渣提取物溶液20ml蒸发至约0.5ml,然后与100g大豆油充分混合。将油分装入15个试管中,每个试管装入5g,随后在110℃下进行脂质过氧化。在特定时间点,采用AOCS官方方法(AOCS, Cd 8-53, 1990)测定各试管的过氧化值(PV)。同时,使用纯大豆油获取空白对照的PV值。此外,还使用含有140ppm BHT的大豆油作为对比。
2.8. 高效液相色谱-电喷雾离子化-质谱联用(HPLC/ESI/MS)分析
对于HPLC/ESI/MS分析,使用的仪器为Finnigan/MAT LCQ离子阱质谱仪(美国加州圣何塞),配备TSP光谱系统,包括UV6000LP PDA检测器、P4000四元泵和AS3000自动进样器。加热毛细管和电压分别保持在200℃和4.5kV。氮气作为鞘气流速运行压力为80psi,辅助气流速为20psi。在正负模式下均采集m/z 50-2000的全扫描质谱,扫描速度为1秒/扫描。色谱分离在Shim-Pack VP-ODS柱(250 × 4.6mm内径)(日本京都岛津公司)上进行,配有保护柱(GVP-ODS,10 × 4.6mm内径),采用以下洗脱条件:流速=600μL/min;室温(27℃);溶剂A为0.1%甲酸水溶液;溶剂B为甲醇,初始条件为20%B,20分钟内升至50%B,再用25分钟升至90%B,最后在5分钟内降至20%B以清洗和再生色谱柱。
3. 结果与讨论
3.1. 杨桃中抗氧化剂的提取
图1显示了溶剂类型和溶剂与水比例对提取物抗氧化能力的影响,抗氧化能力与加入提取物后414nm吸光度降低成正比。丙酮/水提取体系比乙醇/水体系具有更高的提取效率。配对样本t检验表明,在溶剂比例为30%(p < 0.05)、50%(p < 0.10)、70%(p < 0.05)和100%(p < 0.05)时,丙酮与乙醇之间存在显著差异。丙酮/水50/50混合物获得最高的抗氧化活性提取效率。在室温下对匀浆杨桃进行提取,对另外四批杨桃显示出相似的趋势(数据未显示)。因此,选择50%水相丙酮作为提取溶剂。
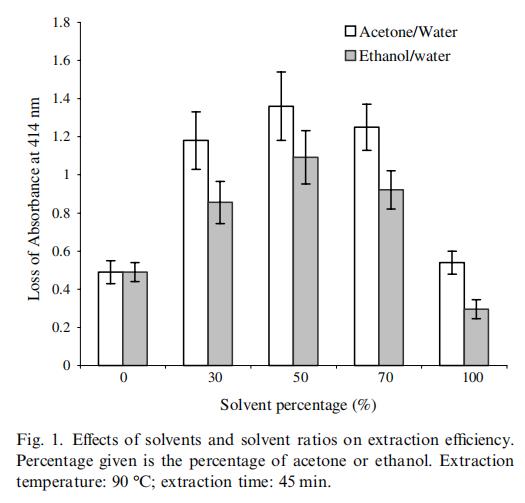
图2显示了温度对提取效率的影响。用于最佳提取温度测试的五批杨桃中,随着温度升高,提取效率逐渐增加。尤其在30至75℃时观察到显著增加。考虑到抗氧化剂在高温下的稳定性,选择90℃作为合适的提取温度。
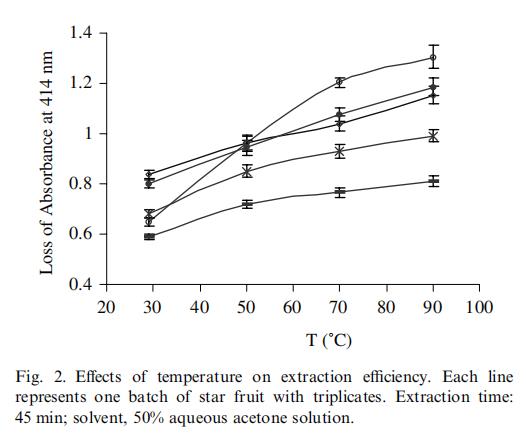
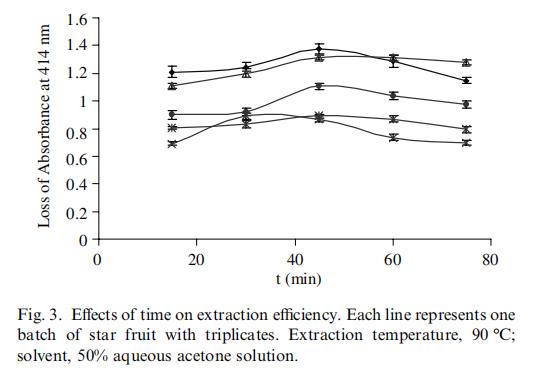
图3给出了不同提取时间对提取效率的影响。随着提取时间的增加,提取效率增加,并在30至60分钟时达到最高值。在测试的五批杨桃中,四批在45分钟时获得最高提取效率,只有一批在30分钟时达到最高值。因此,选择45分钟作为最佳提取时间。
综上所述,用于提取的最佳条件为:50%水相丙酮作为提取溶剂,在90℃下提取45分钟。
3.2. 杨桃中抗氧化剂的分布
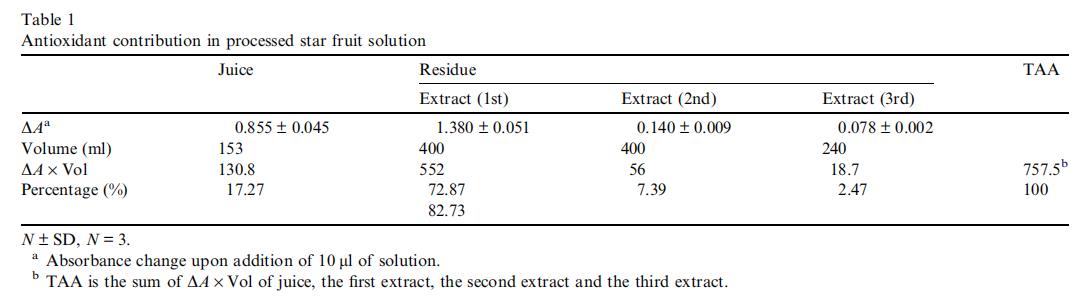
我们之前的研究表明,以单链二聚体至五聚体形式存在的原花青素最可能是杨桃中的主要抗氧化剂(Shui & Leong, 2004)。如表1所示,第一次提取物占杨桃总抗氧化活性的73%,第二次和第三次提取物分别占7%和2%。果汁仅占TAA的17%,但可能占总重量的约85%。因此,大部分抗氧化剂存在于非果汁的残渣中。
3.3. TAA与总多酚含量的相关性
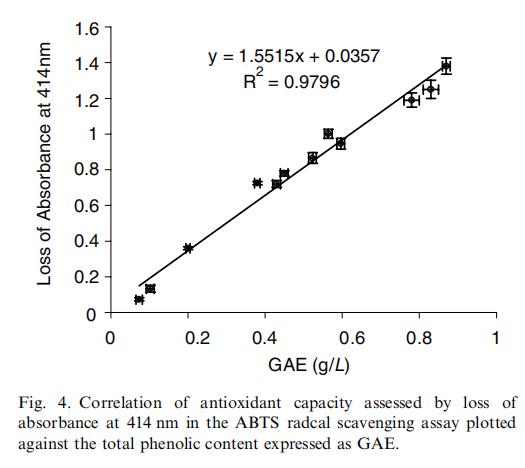
本研究中,分别从果汁、30、50、70和90℃下的单次残渣提取物、90℃下不同丙酮百分比的单次残渣提取物以及多次提取物中取样。果汁和残渣提取物的总抗氧化活性与其总多酚含量有很好的相关性(图4)。这一结果与我们之前的结果一致,即多酚化合物是杨桃中的主要抗氧化剂(Shui & Leong, 2004)。发现残渣占整个果实总多酚含量的70%以上。
3.4. 抑制脂质过氧化
脂肪和脂质容易受到氧化损伤,这与过氧化物和氢过氧化物的形成有关,可能对健康有害。不饱和脂肪特别容易受到这类损害。抗氧化剂可以阻止这些产物的形成及其进一步分解。分解产物会使食物产生异味和异嗅,最终导致酸败。因此,抗氧化剂能够减缓酸败过程,大大延长食品的保质期。
丁基羟基甲苯(BHT)是一种广泛用于食品工业的合成抗氧化剂,主要用于抑制富含油脂和脂肪食品因自氧化引起的异味、气味和颜色变化。出于安全考虑,美国食品药品监督管理局(FDA)限制BHT在食品中的使用量不超过其油脂或脂肪含量的0.02%或200ppm。
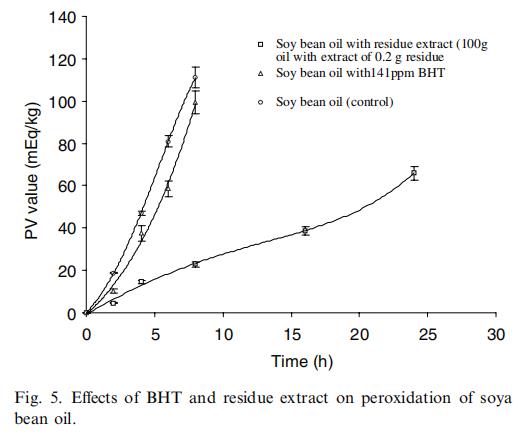
本研究发现,与BHT相比,残渣提取物中的抗氧化剂在很大程度上显著减缓了油脂酸败的过程(图5)。这一结果表明,杨桃中的抗氧化剂有可能用于防止油脂酸败。
3.5. 残留物提取物的自由基清除能力和FRAP
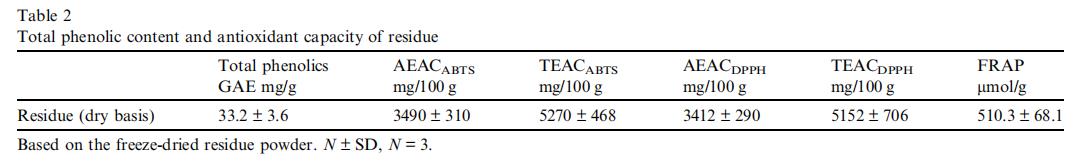
如表2所示,残留物的AEAC值极高(超过3000 mg AEAC/100 g冻干残留物粉末)。总多酚含量和FRAP值也非常高。这表明,杨桃残留物是抗氧化营养补充剂或功能性食品添加剂中优良的多酚抗氧化剂来源。
3.6. 残留物与Pycnogenol药片的多酚谱和抗氧化能力比较
本研究发现,10颗杨桃残留物的AEACABTS值接近一瓶含有40粒Pycnogenol药片的值,而后者的价格是前者的8倍。由于在果汁饮料加工过程中残留物可能被丢弃,其商业潜力被严重低估。
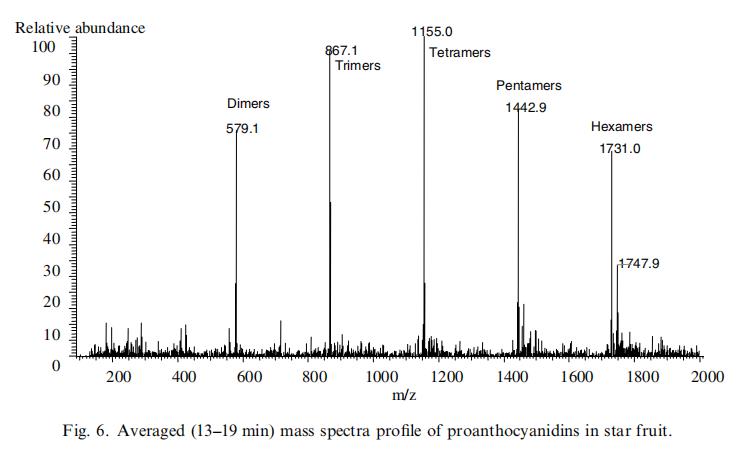
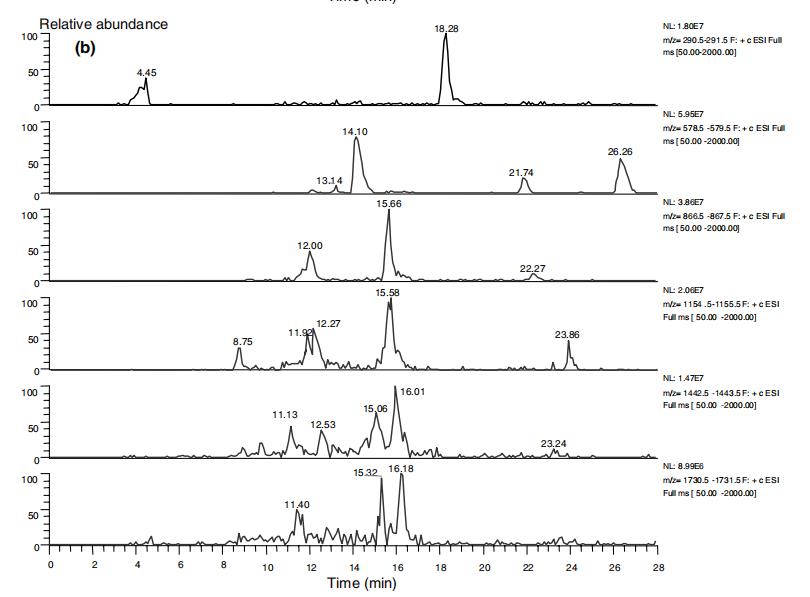
如前所报导(Shui & Leong, 2004),杨桃主要抗氧化剂的HPLC/ESI/MS/MS谱与Pycnogenol原花青素的ESI/MS/MS谱相似,因此存在于杨桃中的二聚体至五聚体形式的原花青素得以表征。然而,由于质谱可能无法区分同分异构体,杨桃的原花青素谱可能与Pycnogenol不同。主要抗氧化剂在(+)-儿茶素(Rt ≈ 14分钟)和(+)-表儿茶素(Rt ≈ 18分钟)之间洗脱(Shui & Leong, 2004)。图6显示了本研究样本在13-19分钟内的平均质谱轮廓。在这里还观察到了六聚体离子[M + H]+在m/z 1731处的峰。这可能是由于杨桃质量的季节性变化或实验中使用的不同品种杨桃所致。
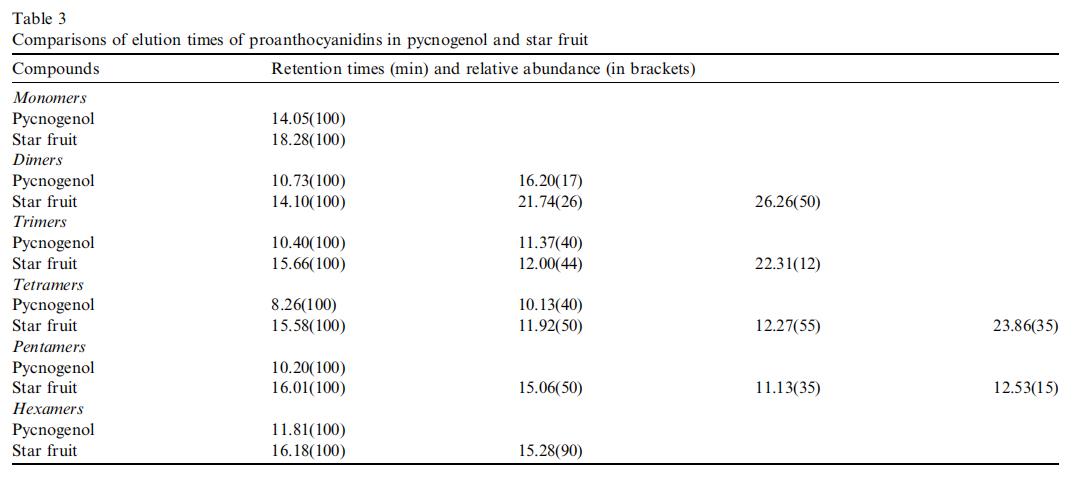
Pycnogenol是从法国海松树皮(PBE)提取的一种高度标准化的某些多酚化合物混合物,其中包含80-85 wt%的原花青素。图7(a)和(b)分别显示了Pycnogenol和杨桃残留物提取物中原花青素的色谱洗脱轮廓。表3总结了杨桃和Pycnogenol中原花青素的色谱轮廓。发现杨桃和Pycnogenol中的原花青素谱是不同的。例如,(+)-表儿茶素(Rt = 18.28分钟)是杨桃中的主要单体,而(+)-儿茶素(Rt = 14.05分钟)是Pycnogenol中的主要单体。此外,Pycnogenol中的主要原花青素异构体洗脱速度比杨桃中的原花青素异构体快。例如,杨桃中其他主要原花青素二聚体至六聚体的洗脱时间为14.10、15.66、15.58、16.01、16.18分钟,而Pycnogenol中相应洗脱时间为10.73、10.40、8.26、10.20、11.81分钟(表3)。这可能意味着杨桃中主要的原花青素成分是(+)-表儿茶素,而(+)-儿茶素是Pycnogenol中主要的原花青素成分。
多酚尤其是原花青素的高含量,对杨桃残留物提取物的高抗氧化能力做出了贡献。这表明其作为营养补充资源或功能性食品成分的巨大商业潜力。需要对杨桃中原花青素的结构鉴定和定量进行进一步研究,以了解其原花青素谱和这些化合物可能的膳食摄入量。虽然已有报道称Pycnogenol具有健康效果(Devarajet al., 2002; Maritim, Dene, Sanders, & Watkins, 2003; Packer, Rimbach, & Virgili, 1999; Rohdewald, 2002; Youm & Kim, 2003),但杨桃的潜在健康效果也需要进行研究。
4.参考文献
AOCS. 1990. 官方方法Cd 8-53, 美国油脂化学家协会,香槟,IL。
Brand-Williams, W., Cuvelier, M. E., & Berset, C. (1995). 利用自由基方法评价抗氧化活性。Lebensmittel-Wissenschaft und Technologi, 26, 25–30。
Benzie, I. F. F., & Strain, J. J. (1999). 铁还原/抗氧化能力测定法:直接测定生物流体总抗氧化活性的方法及同时测定总抗氧化能力和抗坏血酸浓度的改良版本。Methods in Enzymology, 299, 15–27。
Cevallos-Casals, B. A., & Cisneros-Zevallos, L. (2003). 安第斯紫玉米和红肉甘薯抗氧化剂的计量学和动力学研究。Journal of Agricultural and Food Chemistry, 51, 3313–3319。
Devaraj, S., Vega-Lopez, S., Kaul, N., Schonlau, F., Rohdewald, P., & Jialal, I. (2002). 补充富含多酚的松树皮提取物可提高血浆抗氧化能力并改变血浆脂蛋白谱。Lipids, 37, 931–934。
Lachance, P. A. (2002). 营养保健品,真实存在。Food Technology, 56, 20–20。
Lachance, P. A., Nakat, Z., & Jeong, W. S. (2001). 抗氧化剂:整合性方法。Nutrition, 17, 835–838。
Leong, L. P., & Shui, G. (2002). 对新加坡市场水果抗氧化能力的调查。Food Chemistry, 76, 69–75。
Maritim, A., Dene, B. A., Sanders, R. A., & Watkins, J. B. (2003). 在链脲佐菌素诱导糖尿病大鼠中,Pycnogenol治疗对氧化应激的影响。Journal of Biochemical and Molecular Toxicology, 17, 193–199。
Matthaus, B. (2002). 从不同油籽残渣中提取物的抗氧化活性。Journal of Agricultural and Food Chemistry, 50, 3444–3452。
Moure, A., Cruz, J. M., Franco, D., Dominguez, J. M., Sineiro, J., Dominguez, H., 等人. (2001). 来自剩余资源的天然抗氧化剂。Food Chemistry, 72, 145–171。
Packer, L., Rimbach, G., & Virgili, F. (1999). 来自松树(Pinus maritima)树皮的富含原花青素提取物Pycnogenol的抗氧化活性和生物药理学特性。Free Radical Biology and Medicine, 27, 704–724。
Rohdewald, P. (2002). 一种具有多样临床药理学的草药药物——法国海松树皮提取物(Pycnogenol)的综述。International Journal of Clinical Pharmacology and Therapy., 40, 158–168。
Shui, G. H., & Leong, L. P. (2004). 利用液相色谱和质谱分析杨桃中的多酚类抗氧化剂。Journal of Chromatography A, 1022, 67–75。
Singleton, V. L., & Rossi, J. A. (1965). 用磷钼酸-磷钨酸试剂测定总酚。American Journal of Enology and Viticulture, 16, 144–158。
Youm, J. A., & Kim, Y. G. (2003). 在缺乏HP1和超氧化物歧化酶活性的Escherichia coli突变株中,在氧化应激条件下考察Pycnogenol的抗氧化潜能。Journal of Microbiology, 41, 28–33。
Wolfe, K. L., & Liu, R. H. (2003). 苹果皮作为一种增值食品成分。Journal of Agricutural and Food Chemistry, 51, 1676–1683。
Wolfe, K. L., Wu, X. Z., & Liu, R. H. (2003). 苹果皮的抗氧化活性。Journal of Agricutural and Food Chemistry, 51, 609–614。
