摘 要
引言
杨桃(Averrhoa carambola L.)属牻牛儿苗目、科酢浆草科、五敛子属,俗称五敛子、三菍、阳桃、洋桃、酸五棱、木踏子、风鼓,主要分布于热带及亚热带地区,为南方名果,原产于马来西亚,在我国主要分布于南部地区,以广东最多,在台湾、海南、广西、福建等省份也有栽植。杨桃的果实呈五棱形,成熟时黄绿色至鲜黄色,其果皮非常薄,果肉清脆,可食部分占总体92%以上,是一种新型的低糖类水果[1],深受消费者喜爱。杨桃中含有丰富的糖类、蛋白质、脂肪、氨基酸、矿物质、纤维素、有机酸、维生素等营养物质[2-3]及多酚、黄酮等活性成分[4],有降低血糖、血脂、胆固醇及消除炎症等作用[5-6]。
多酚是一类具有多酚羟基化合物的总称,主要分布在水果、蔬菜及谷物等植物中,具有独特的抗氧化、抗肿瘤、抗病毒等生物活性[7-9],还有抑菌、抗炎、预防心脑血管疾病等药理活性[10-11],广泛应用于食品、医药、生态保护、农业及化妆品等多个领域[12]。植物多酚具有供氢能力和结合自由基的能力,对自由基具有一定的清除能力,是水果中一种主要的天然抗氧化剂。李武等[13]对12种热带水果的多酚含量及抗氧化性展开研究,发现杨桃总酚含量最高,且具有最高的氧自由基吸收能力(oxygenradicalabsorbancecapacity,ORAC)和铁离子还原能力(ferric reducing antioxidant power,FRAP)。在陈晨等[14]的研究中,香蕉皮多酚粗提取物清除羟自由基的能力高于同质量浓度的抗坏血酸,而清除DPPH自由基的能力低于抗坏血酸。油脂的氧化酸败是游离自由基攻击油脂中不饱和脂肪酸上双键碳原子的连锁反应,在冯航[15]的研究中可知多酚具有抑制油脂中过氧化物形成的作用。
本研究以杨桃为材料,在前期研究基础上,采用超声波辅助提取法得到杨桃多酚提取液[16],通过探究其总抗氧化能力、DPPH自由基清除作用、羟自由基清除作用和油脂过氧化抑制作用来全面测定和评价其体外抗氧化活性,以期为杨桃及其多酚的综合和深入开发利用提供可靠的理论和试验依据。
1 材料与方法
1.1 材料与试剂
杨桃:广东廉江红唇杨桃,市售;花生油:湛江市麻章区贵滴食品有限公司。
总抗氧化能力(total antioxidative ability,T-AOC)测试盒:南京建成生物工程研究所;1,1-二苯基-2-三硝基苯肼(DPPH):梯希爱(上海)化成工业发展有限公司;七水硫酸亚铁、水杨酸、30%过氧化氢、氯仿、冰醋酸、碘化钾、硫代硫酸钠、没食子酸、抗坏血酸、无水乙醇、福林试剂、碳酸钠(分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
电热鼓风干燥箱(DHG-9075A)、电热恒温水浴锅(HWS-24):上海一恒科学仪器有限公司;电子天平(AUX320):日本岛津公司;超声波清洗器(KQ-500V):昆山市超声仪器有限公司;低速离心机(TD-6):长沙湘智离心机仪器有限公司;循环水式真空泵[SHZ-D(Ⅲ)]、旋转蒸发仪(YRE-5299):巩义市予华仪器有限责任公司;恒温培养振荡器(HNY-200B):天津市欧诺仪器仪表有限公司。
1.3 试验方法
1.3.1 杨桃多酚的提取及其质量浓度测定
将杨桃切碎,50℃烘干后粉碎,40目过筛,将得到的样品置于低温干燥条件下保存备用。准确称取一定量的杨桃样品于250 mL具塞三角瓶中,按照料液比为1∶50(g/mL),加入适量60%乙醇溶液,采用超声波频率为40 kHz、功率为500 W的超声波清洗器60℃条件下超声波辅助提取30min后,4000r/min离心15min[16]。取上清液于50℃真空旋转蒸发浓缩[14]后定容至100mL,得到杨桃多酚提取液,采用福林酚法测定杨桃提取液质量浓度[17]。
1.3.2 杨桃多酚总抗氧化能力的测定
采用FRAP法按照T-AOC试剂盒说明书检测总抗氧化能力,分别取浓度为 0.15、0.3、0.6、0.9、1.2、1.5mmol/L的FeSO4·7H2O 标准溶液 5 μL,各加入 180 μL FRAP 工作液,混匀后37℃孵育4 min,测定其OD593nm。以FeSO4浓度(μmol/L)为横坐标,OD593nm为纵坐标,绘制FRAP测定标准曲线[18]。根据测得的杨桃多酚提取液质量浓度,将其稀释为 10、20、30、40、50、60 μg/mL,同时以等浓度的抗坏血酸作阳性对照。用移液器取5 μL溶液,加入FRAP工作液180 μL,混匀后37℃孵育4 min,测定其OD593 nm。将其代入FRAP测定标准曲线,得到其所对应的FeSO4浓度,绘制关系曲线,样品的总抗氧化能力以FRAP值表示,即总抗氧化能力相当于FeSO4的 μmol/L 数[19]。
1.3.3 杨桃多酚提取液清除羟自由基能力的测定
根据郑菲[20]的水杨酸法稍加修改。考察不同的反应温度(30、40、50、60、70、80 ℃)条件下,加入不同体积的杨桃多酚提取液(0.25、0.5、1.0、1.5、2.0、2.5、3.0 mL)的羟自由基清除能力。固定在试管中加入1 mL 6 mmol/L硫酸亚铁和1 mL 6 mmol/L水杨酸-乙醇溶液,加入不同体积的杨桃多酚提取液和适量的蒸馏水,保证反应体系为5 mL。将其置于试验温度中预热3 min,再加入1 mL的6 mmol/L H2O2,反应10 min后测定其OD510 nm值AX,以蒸馏水代替样品为空白测定OD510 nm值AO,同时以等浓度的抗坏血酸溶液作阳性对照[21]。羟自由基清除率可用公式(1)表示。
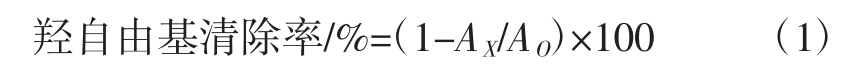
1.3.4 杨桃多酚提取液清除DPPH自由基能力的测定
根据Monica等[22]的方法稍作修改。取不同体积(10、20、30、40、50、60 μL)的杨桃多酚提取液,加入4 mL 0.1 mmol/L DPPH乙醇溶液,加入蒸馏水至8 mL,混匀后放置30 min,于517 nm处测定其OD值AX;取4 mL蒸馏水与4 mL DPPH溶液混匀,测定其OD值AO;取4 mL乙醇与4 mL蒸馏水混匀作空白。同时以同浓度的抗坏血酸作为阳性对照组。DPPH自由基清除率可用公式(2)表示。
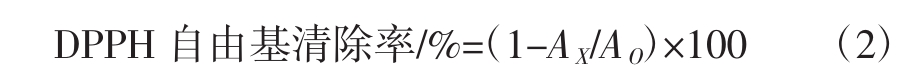
1.3.5 杨桃多酚提取液对花生油过氧化抑制作用的研究
1.3.5.1 不同质量浓度的杨桃多酚提取液对花生油的过氧化抑制作用
称取 12g花生油,加入不同浓度(0、0.5、0.625、0.83、1.25、2.5、5.0 mg/mL)的杨桃多酚提取液 1 mL,同时以加入相同浓度的抗坏血酸为阳性对照,置于55℃的恒温振荡器中,分别测定其第3天的过氧化值[23]。过氧化值的测定参考GB 5009.227-2016《食品安全国家标准食品中过氧化值的测定》[24]。
1.3.5.2 添加杨桃多酚提取液不同的反应时间对花生油过氧化抑制作用
分别测定加入一定浓度杨桃多酚提取液的花生油在第3天、第6天和第9天的过氧化值,同时以加入相同浓度的抗坏血酸为阳性对照。具体步骤和方法同1.3.5.1。
1.4 数据处理
所有试验均独立重复3次,最终取其数据平均值。采用SPSS 17.0软件进行数据的显著性分析。单因素方差分析两两间显著性检验采用最小显著差异法(least significance difference,LSD)法,P=0.05为显著性水平。两组间显著性检验采用配对样本t检验的分析方法,P<0.05即认为具有显著性差异。
2 结果与分析
2.1 杨桃多酚提取液的质量浓度
试验得出以没食子酸为标准品的总酚含量测定标准曲线回归方程为y=1.379 8x-0.016 1,相关系数R2=0.996 1。所得标准曲线如图1所示。
由图1可知,采用没食子酸作为总多酚测定的标准物质时,其在765 nm处的吸光度OD765nm与其浓度呈良好的线性关系。测定杨桃多酚提取液的吸光度值,根据以上没食子酸标准曲线的回归方程,可得杨桃多酚提取液的浓度为5.2 mg/mL。后续总抗氧化能力、羟自由基清除能力及DPPH自由基清除能力试验中所使用的杨桃多酚提取液均是以此浓度杨桃多酚提取液稀释一定倍数得到的溶液。
2.2 杨桃多酚提取液总抗氧化能力
2.2.1 FRAP法测定标准曲线
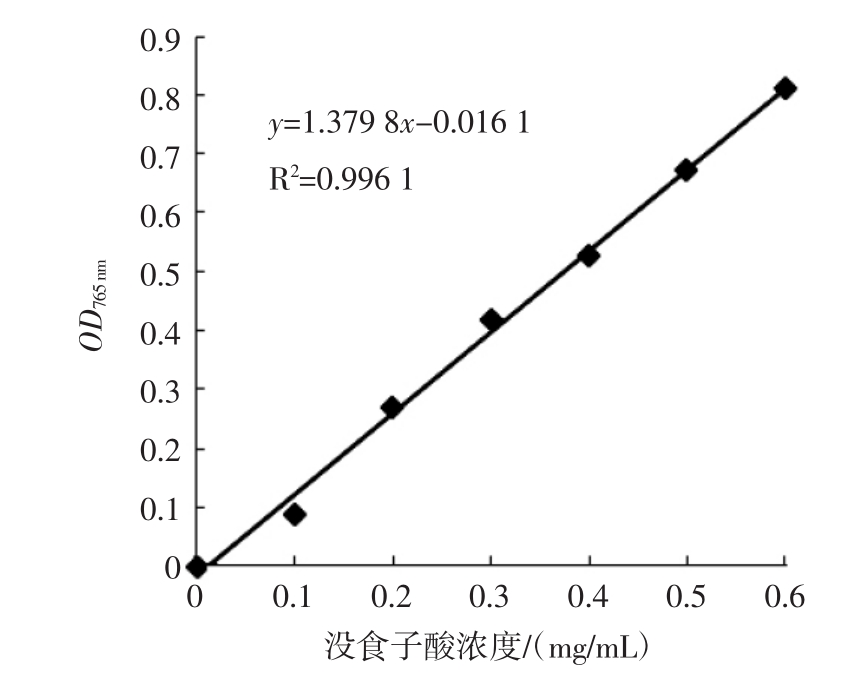
图1 没食子酸标准曲线图
Fig.1 The standard curve of gallic acid
试验确定了以FeSO4·7H2O为标准品的FRAP测定标准曲线回归方程为y=0.000 06x+0.002 2,相关系数R2=0.992 2。所得标准曲线如图2所示。FeSO4浓度在0~1 500 μmol/L范围内与其在593 nm处的吸光度具有良好的线性关系。
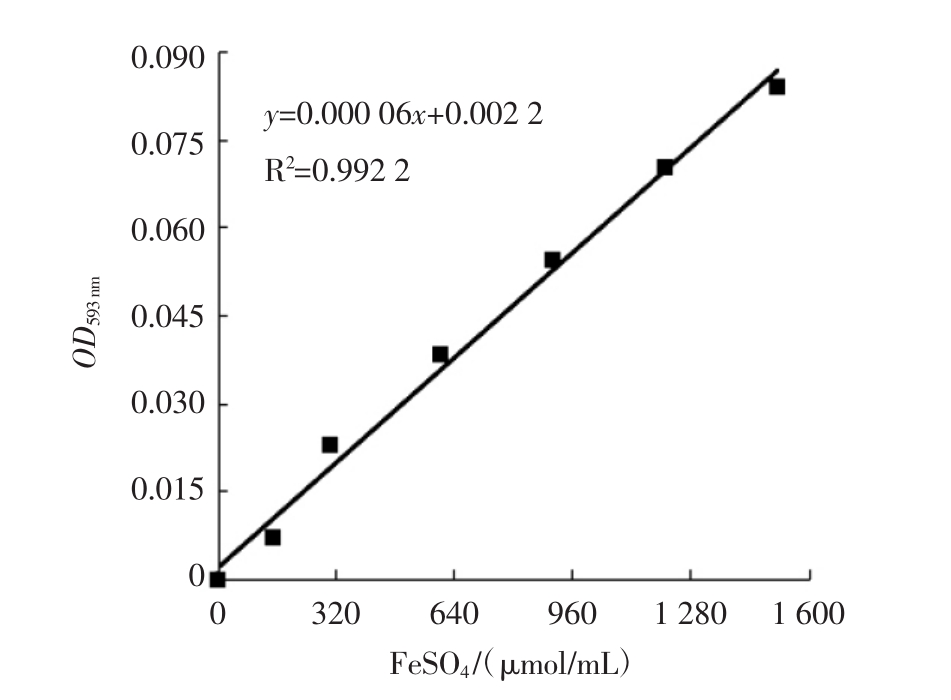
图2 FRAP测定标准曲线
Fig.2 The standard curve of FRAP
2.2.2 杨桃多酚提取液的总抗氧化能力
不同质量浓度的杨桃多酚提取液和抗坏血酸溶液总抗氧化能力的试验结果如图3所示。
根据2.2.1所得的FRAP测定标准曲线,计算在FRAP测定中杨桃多酚提取液和抗坏血酸溶液测得的OD值所对应的FeSO4浓度。x为杨桃多酚提取液质量浓度,y为FeSO4浓度,试验测得抗坏血酸溶液的线性回归方程为y=18.099x+15.278,相关系数R2=0.999;杨桃多酚提取液的线性回归方程为y=14.488x-32.341,相关系数R2=0.996 3。结果表明,在研究的浓度范围内,杨桃多酚提取液和抗坏血酸的总抗氧化能力随着其质量浓度升高而增加,且均存在很好的线性关系。经测算,5.2 mg/mL杨桃多酚提取液总抗氧化能力的FRAP值为72 103.5 μmol/mL,相同浓度的抗坏血酸溶液总抗氧化能力的FRAP值为95 642.6 μmol/mL。此外,在研究的质量浓度范围内,相同质量浓度的抗坏血酸的总抗氧化能力高于杨桃多酚提取液。
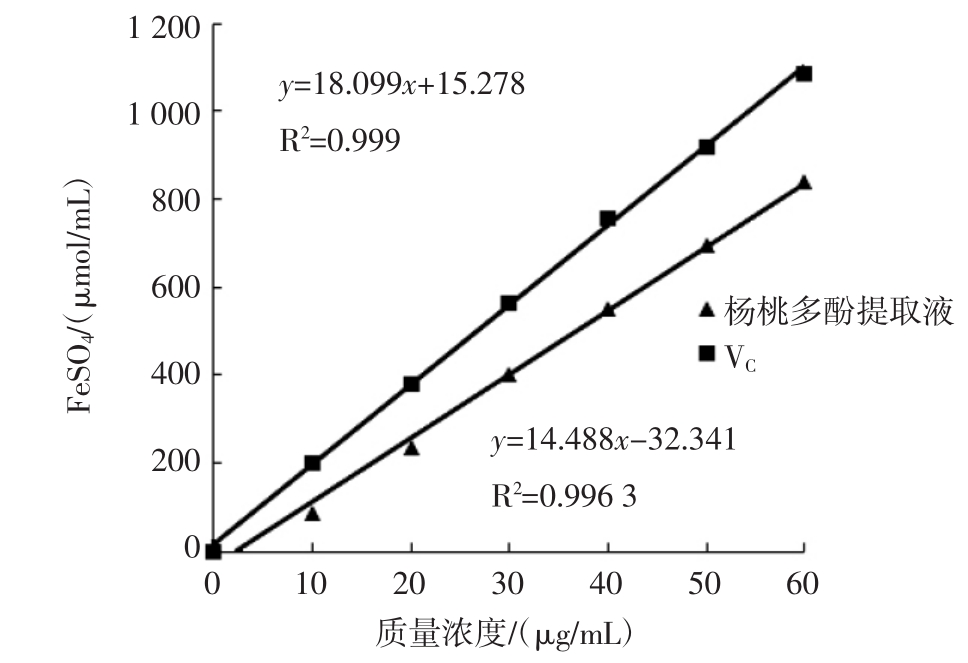
图3 不同质量浓度的杨桃多酚提取液和抗坏血酸溶液的总抗氧化能力
Fig.3 Total antioxidant capacity of carambola polyphenols extract and ascorbic acid solution in different mass concentration
2.3 杨桃多酚提取液对羟自由基的清除作用
2.3.1 不同体积的杨桃多酚提取液对羟自由基的清除作用
在30℃的反应温度条件下,同一质量浓度的不同体积杨桃多酚提取液和抗坏血酸溶液对羟自由基清除作用的结果如图4所示。
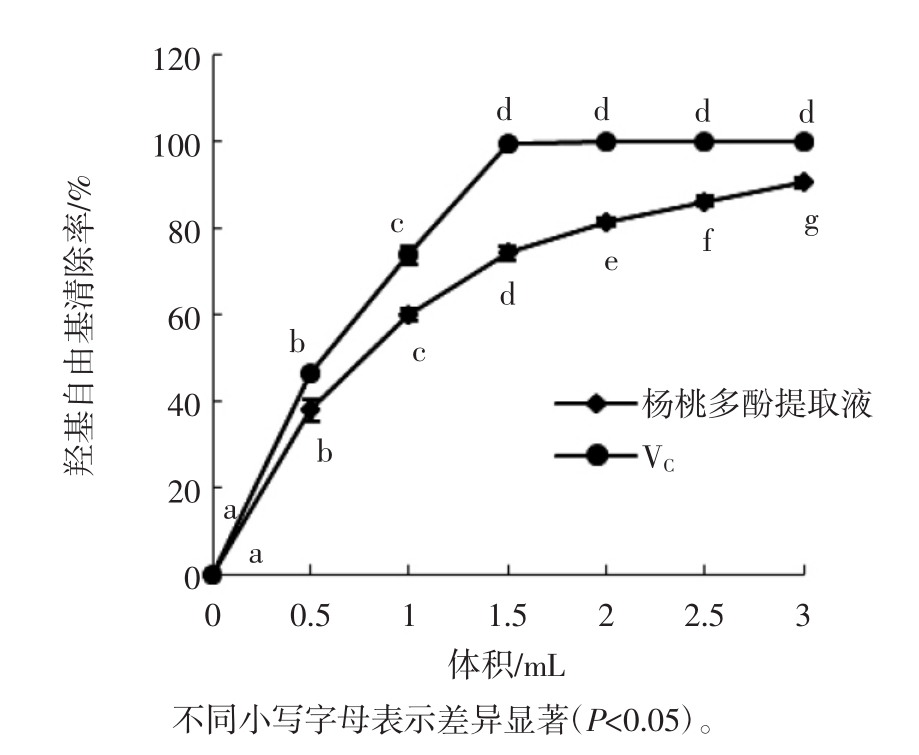
图4 不同体积的杨桃多酚提取液和抗坏血酸溶液对羟自由基清除作用的影响
Fig.4 Effect of different volume of carambola polyphenol extract and ascorbic acid solution on hydroxyl free radical scavenging capacity
由图4可知,杨桃多酚提取液和抗坏血酸溶液对羟自由基的清除能力在一定范围内随着体积的增加而增强。差异性分析表明,当抗坏血酸溶液体积低于1.5 mL以及杨桃多酚提取液的体积在研究的体积范围内,各体积间的羟基自由基清除率差异显著(P<0.05)。一定浓度的抗坏血酸对羟自由基的清除率在体积小于1.5 mL时呈现出明显的上升趋势,当体积为1.5 mL时抗坏血酸对羟自由基的清除率达99%以上,羟自由基基本已被清除。在研究的体积范围内,随着杨桃多酚提取液体积的增加,羟自由基清除率逐渐增加,最高可达90%以上,说明杨桃多酚提取液有良好的自由基清除能力。此外,同一质量浓度条件下,杨桃多酚提取液清除羟自由基的能力均低于相同浓度的抗坏血酸溶液。
2.3.2 杨桃多酚提取液在不同温度条件下对羟自由基的清除作用
在不同温度条件下,相同体积且相同质量浓度的杨桃多酚提取液和抗坏血酸溶液对羟自由基清除能力的影响结果如图5所示。
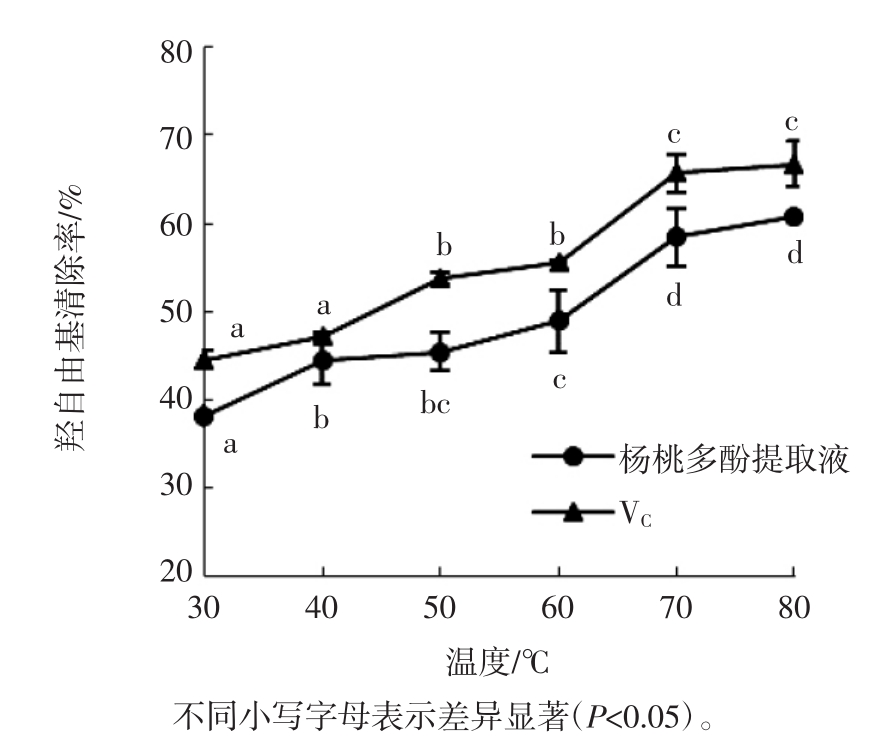
图5 不同温度对杨桃多酚提取液及抗坏血酸清除羟自由基作用的影响
Fig.5 Effects of different temperatures on the hydroxyl radical scavenging capacity of carambola polyphenol extract and ascorbic acid solution
由图5可知,在一定温度范围内,杨桃多酚提取液与抗坏血酸溶液对羟自由基的清除率随着温度的升高而逐渐升高。此外,同一温度条件下,杨桃多酚提取液清除羟自由基的能力略低于相同浓度的抗坏血酸。
2.4 杨桃多酚提取液对DPPH自由基的清除作用
同一质量浓度的不同体积杨桃多酚提取液和抗坏血酸溶液对DPPH自由基的清除作用结果如图6所示。
由图6可知,在一定体积范围内,随着体积的增大,杨桃多酚提取液和抗坏血酸溶液对DPPH自由基的清除率逐渐增加。显著性差异分析表明,当抗坏血酸溶液体积低于40 μL以及杨桃多酚提取液体积低于50 μL时,各体积间的DPPH自由基清除率差异显著(P<0.05)。当抗坏血酸溶液添加量为40 μL时,DPPH自由基的清除率达90%以上,继续增加抗坏血酸溶液体积,其DPPH自由基清除率不再增加;杨桃多酚提取液的添加量为50 μL时的清除率可达到80%以上,继续增大体积,其DPPH自由基清除率也不再增加。另外,在相同质量浓度条件下,杨桃多酚提取液对DPPH自由基的清除能力略低于抗坏血酸。
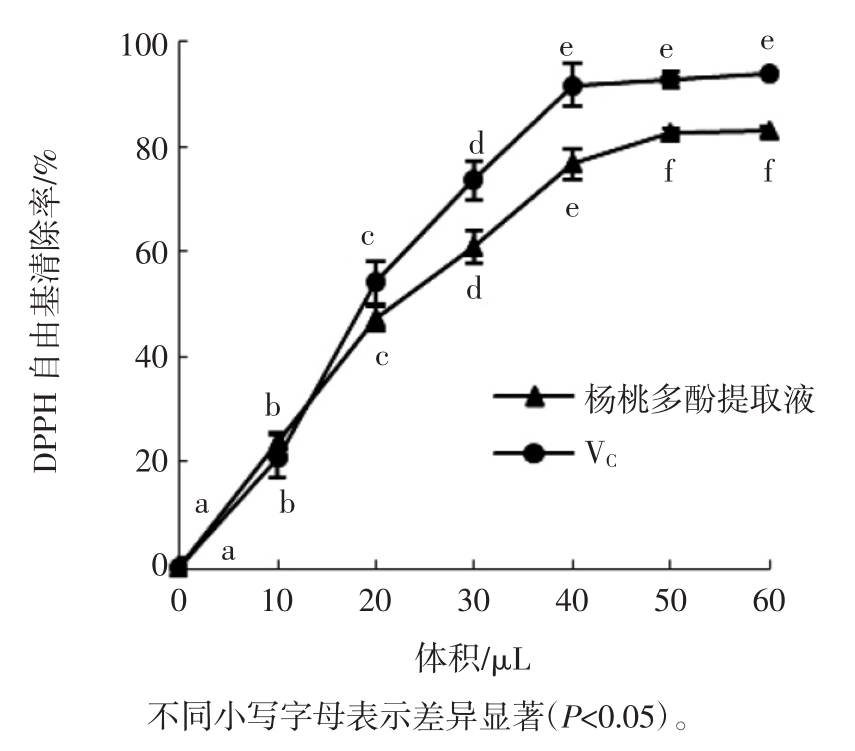
图6 不同体积杨桃多酚提取液和抗坏血酸溶液对DPPH自由基清除作用的影响
Fig.6 Effectsofdifferentvolumesolutionsofcarambolapolyphenol extract and ascorbic acid solution on DPPH free radical scavenging capacity
2.5 杨桃多酚提取液对花生油的过氧化抑制作用
2.5.1 不同质量浓度的杨桃多酚提取液对花生油的过氧化抑制作用的影响
在55℃反应温度条件下,添加不同浓度的杨桃多酚提取液和抗坏血酸溶液的花生油在第3天的过氧化值(peroxide value,POV)如图7所示。
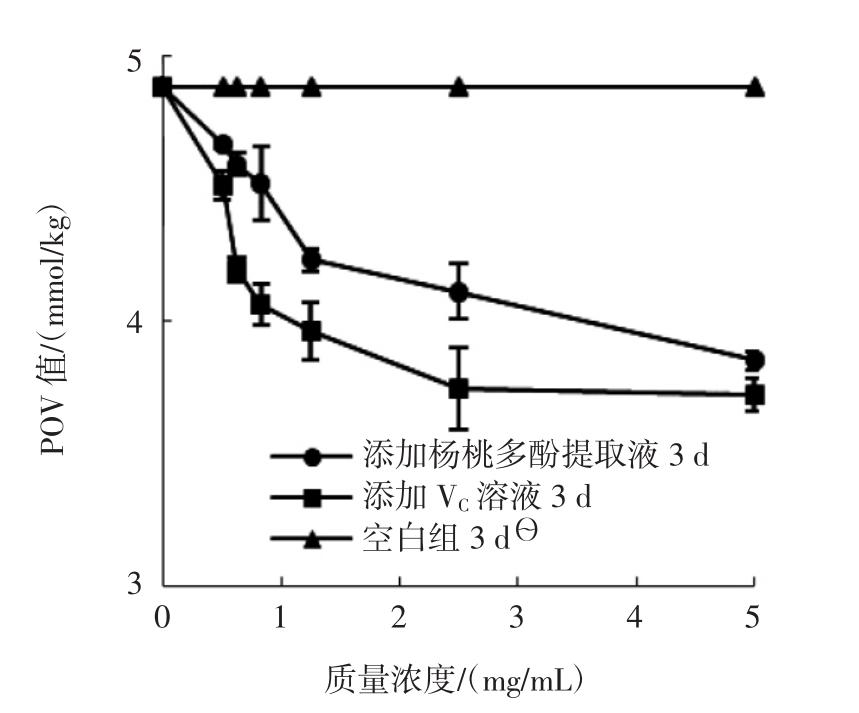
图7 添加不同浓度的杨桃多酚提取液和抗坏血酸溶液对花生油过氧化值的影响
Fig.7 Effects of different adding concentration of carambola polyphenols extract and ascorbic acid solution on the peroxide value in peanut oil
油脂的过氧化值表示油脂被氧化程度,测得花生油的POV越大,其所含有的过氧化物越多,表示被氧化程度越大。由图7可知,添加不同浓度的杨桃多酚提取液和抗坏血酸溶液的花生油POV值均小于空白组的花生油POV值。
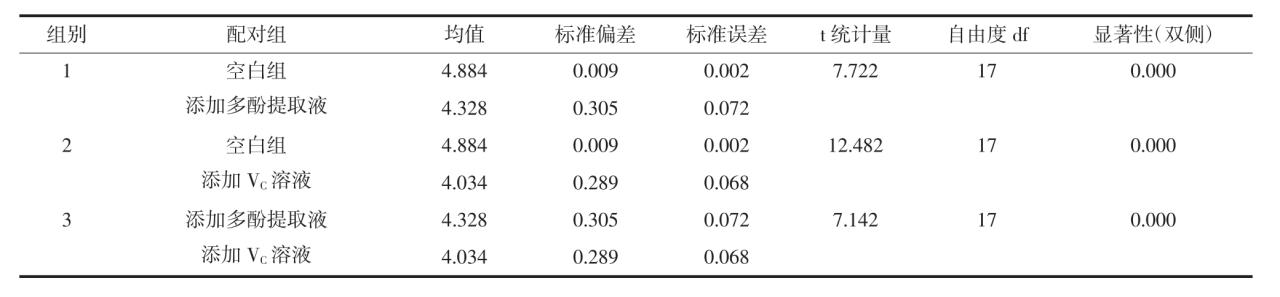
添加不同浓度多酚提取液和VC溶液的花生油POV值的双样本配对t检验结果见表1。
由表1可知,添加不同浓度的杨桃多酚提取液和抗坏血酸溶液的花生油与其空白组的POV值均差异显著(表1中1、2配对组的P<0.05),说明添加不同浓度杨桃多酚提取液和抗坏血酸溶液对花生油中过氧化物的生成具有一定的抑制作用。另外,随着杨桃多酚提取液和抗坏血酸溶液添加浓度的增加,花生油中过氧化物的含量越低,说明在研究的添加浓度范围内,杨桃多酚提取液和抗坏血酸溶液对花生油中过氧化物生成的抑制作用随着添加浓度增加而增强。表1中的第3组配对组P<0.05,说明添加不同浓度的杨桃多酚提取液和抗坏血酸溶液的花生油POV值差异显著,即两者对花生油过氧化抑制效果差异显著。在相同质量浓度条件下,添加杨桃多酚提取液的花生油POV值均高于添加了抗坏血酸的花生油,说明杨桃多酚提取液对花生油的过氧化抑制作用弱于抗坏血酸溶液。
表1 添加不同浓度多酚提取液和VC溶液的花生油POV值的双样本配对t检验结果
Table 1 Two sample paired t-test of adding different concentration of carambola polyphenols extract and ascorbic acid solution on the analysis of POV value in peanut oil
2.5.2 不同反应时间对添加杨桃多酚提取液的花生油过氧化抑制作用的影响
不同反应时间对杨桃多酚提取液和抗坏血酸溶液的花生油POV值的影响结果如图8所示。
随着时间的增加,空白组和其他处理组的花生油POV值逐渐上升,但添加了杨桃多酚提取液和抗坏血酸溶液的花生油POV值均小于空白组的花生油,空白组的花生油与添加杨桃多酚提取液和抗坏血酸溶液的花生油中POV值的差值随着时间增加而增大。
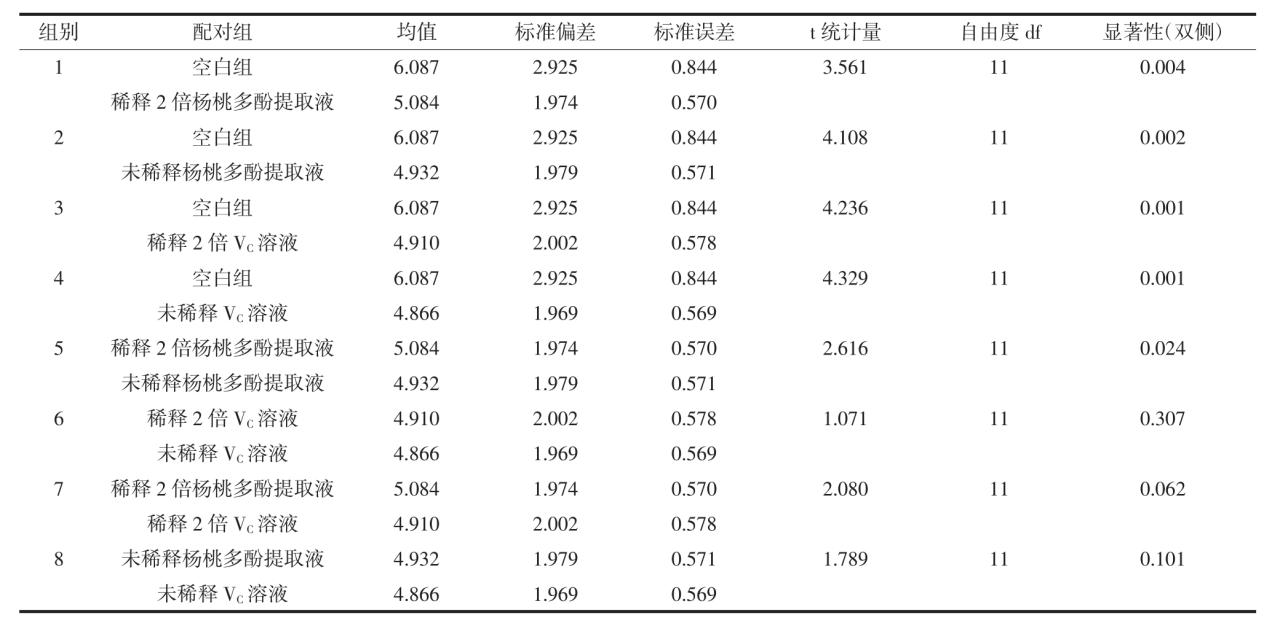
不同的处理组花生油贮藏3、6、9 d POV值的双样本配对t检验结果见表2。
由表2可知,空白组和其他所有处理组的花生油POV 值差异显著(表 2中 1、2、3、4配对组 P<0.05),说明在研究的贮藏时间范围内,杨桃多酚提取液和抗坏血酸溶液对花生油中过氧化物的生成具有一定的抑制效果,并且随着时间的增加这种抑制效果增强。表2中的7、8配对组P>0.05,说明不管是添加稀释2倍多酚提取液和VC溶液还是未稀释的多酚提取液和VC溶液的花生油,反应不同的时间,其POV值差异不显著,即两者对花生油过氧化抑制效果差异不显著。
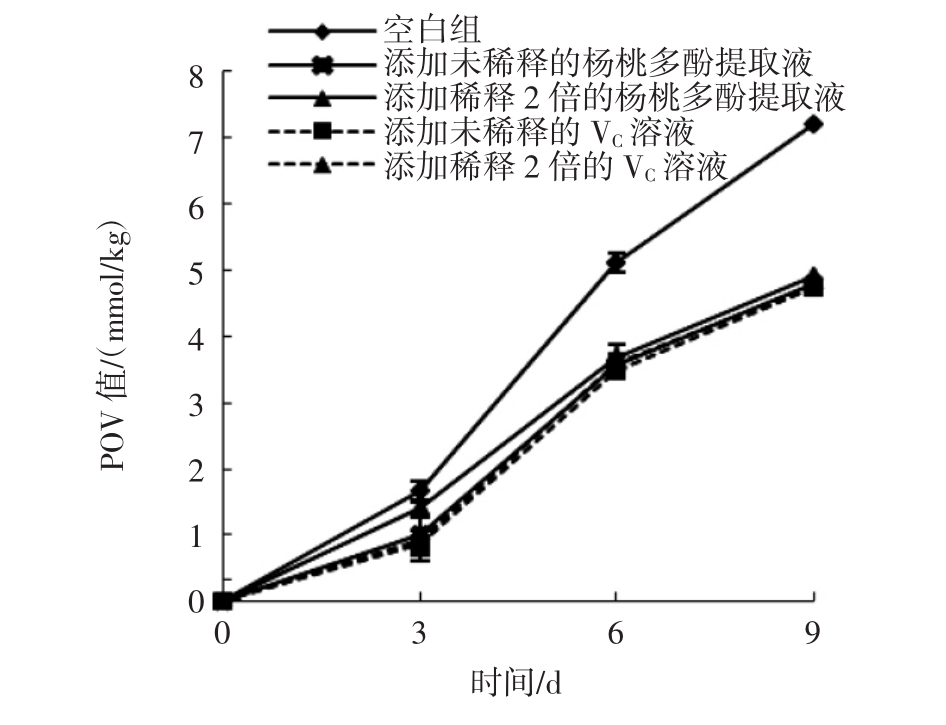
图8 不同反应时间对添加杨桃多酚提取液和抗坏血酸溶液的花生油过氧化值的影响
Fig.8 Effects of different reaction time on the peroxide value of peanut oil adding carambola polyphenols extract and ascorbic acid solution
表2 不同的处理组花生油贮藏3、6、9 d POV值的双样本配对t检验结果
Table 2 Two sample paired t-test of different treatment group storing for 3 d,6 d and 9 d on the analysis of POV value in peanut oil
3 讨论与结论
对于抗氧化活性的测定方法有多种,所对应的反应原理也各不相同,各具优缺点,为了获得准确和全面的评价结论,需采用多种方法进行测定。本研究从总抗氧化能力、清除羟自由基和DPPH自由基能力和油脂过氧化抑制能力等方面对杨桃多酚提取液的抗氧化活性进行测定和评价,同时采用抗坏血酸溶液作阳性对照,能较全面地评价杨桃多酚提取液的体外抗氧化活性。
在总抗氧化能力方面,5.2 mg/mL杨桃多酚提取液总抗氧化能力的FRAP值为72 103.5 μmol/mL,质量浓度与其总抗氧化能力存在很好的线性关系。在陈玉霞等[19]的研究中,质量浓度为10 mg/mL的41种中草药超声波乙醇提取液的总抗氧化能力的FRAP值在5 μmol/mL~800 μmol/mL,杨桃多酚提取液的总抗氧化能力明显高于41种中草药。在清除羟基自由基方面,随着杨桃多酚提取液体积的增加,羟自由基的清除率逐渐增加,羟自由基的清除率最高可达90%以上,说明杨桃多酚提取液对羟基自由基的清除效果很好。在清除DPPH自由基能力方面,杨桃多酚提取液能清除80%以上的DPPH自由基,在李宁[25]对青荚叶多酚的研究中,青荚叶的粗多酚对DPPH自由基最大清除率为62%,与之相比,杨桃多酚提取液对DPPH自由基的清除效果较好。在花生油过氧化抑制作用方面,在研究的质量浓度范围内,杨桃多酚提取液对花生油中过氧化物的生成具有一定的抑制作用。但是杨桃多酚提取液的总抗氧化能力、清除羟自由基和DPPH自由基能力以及抑制花生油中过氧化物的生成能力均稍弱于同浓度的抗坏血酸。
综上所述,杨桃多酚提取液具有较好的总抗氧化能力、清除羟自由基和DPPH自由基能力以及一定的抑制花生油中过氧化物的生成能力,也是一种有效的天然抗氧化性物质。由于本试验研究的杨桃多酚提取液是粗提液,未经过分离和纯化,其总抗氧化能力、清除羟自由基和DPPH自由基能力、抑制花生油中过氧化物生成的能力均稍弱于同浓度的抗坏血酸,若对杨桃多酚提取液进一步的分离纯化,其活性可能会进一步增加,这也是本研究进一步深入研究的一个重要方向。
[1]钱爱萍.杨桃的氨基酸组成及其营养价值评价[J].中国食物与营养,2012,18(4):75-78
[2]郑洪,张伟强,陈洁,等.杨桃营养与保鲜加工现状与进展[J].东南园艺,2017(4):42-45
[3]戴聪杰,李萍.酸、甜杨桃的营养成分分析[J].中国食物与营养,2010(9):69-72
[4]李晓乐,杨瑞丽,张玉莹,等.6种热带水果多酚组成及其抗氧化活性分析[J].食品研究与开发,2018,39(5):1-7
[5]杨映霞,黄天敏,黄仁彬,等.杨桃果汁对糖尿病模型小鼠的降糖作用及其机制研究[J].广西医科大学学报,2019,36(1):7-10
[6]覃陆慧,吴兴春,周幸,等.杨桃根苯醌对链脲佐菌素致糖尿病小鼠糖脂代谢、氧化应激和炎症损伤的影响[J].中国药理学通报,2019,35(12):1720-1725
[7]Gan R Y,Deng Z Q,Yan A X,et al.Pigmented edible bean Coats as natural sources of polyphenols with antioxidant and antibacterial effects[J].LWT,2016,73:168-177
[8]Burton-Freeman B M,Sandhu A K,Edirisinghe I.Red raspberries and their bioactive polyphenols:cardiometabolic and neuronal health links[J].Advances in Nutrition,2016,7(1):44-65
[9]Mileo A M,Miccadei S.Polyphenols as modulator of oxidative stress in cancer disease:new therapeutic strategies[J].Oxidative Medicine and Cellular Longevity,2016,2016:1-17
[10]Fu G L,Wang H,Cai Y L,et al.Theaflavin alleviates inflammatory response and brain injury induced by cerebral hemorrhage via inhibiting the nuclear transcription factor kappa β-related pathway in rats[J].Drug Design,Development and Therapy,2018,12:1609-1619
[11]张添菊,王帆,李春阳,等.蓝莓叶多酚组成及其抗食源性致病菌活性分析[J].食品科学,2016,37(23):103-107
[12]郭崇婷,李旋,毕金峰,等.疏果活性成分、功能特性及其应用研究进展[J].食品科学,2019,41(11):303-309
[13]李武,李艳君,杨瑞丽.热带水果多酚提取物的抗氧化和抗增殖活性研究[J].现代食品科技,2013,29(10):2383-2387
[14]陈晨,胡文忠,田沛源,等.超声辅助提取香蕉皮多酚工艺优化及其抗氧化性的分析[J].食品科学,2014,35(2):12-17
[15]冯航.枇杷多酚对几种植物油脂的抗氧化作用研究[J].粮食与油脂,2018,31(3):53-54
[16]蒋边,潘进权,李恒,等.响应面优化超声提取杨桃多酚的工艺研究[J].食品工业科技,2016,37(7):248-299
[17]吕群金,衣杰荣,丁勇.Folin-Ciocalteu比色法测定杨桃的多酚含量[J].湖南农业科学,2009,35(7):99-101
[18]马慧,茹鑫,王津,等.4种茶叶水提物及茶多酚的体外抗氧化性能研究[J].食品研究与开发,2019,40(8):65-70
[19]陈玉霞,刘建华,林峰,等.DPPH和FRAP法测定41种中草药抗氧化活性[J].实验室研究与探究,2011,30(6):11-14
[20]郑菲.橡实壳多酚分离纯化、抗氧化及抑菌的研究[D].长沙:中南林业科技大学,2011
[21]崔霖芸.野木瓜果汁体外抗氧化性研究[J].食品工业科技,2017,38(15):6-10
[22]Locatelli M,Gindro R,Travaglia F,et al.Study of the DPPH-scavenging activity:Development of a free software for the correct interpretation of data[J].Food Chemistry,2009,114(3):889-897
[23]李春海,孙卫东.蔗梢多酚提取工艺及抗氧化活性研究[J].中国食品添加剂试验研究,2012(4):181-185
[24]中华人民共和国国家卫生和计划生育委员会.食品安全国家标准食品中过氧化值的测定:GB 5009.227-2016[S].北京:中国标准出版社,2016:1-6
[25]李宁.超声辅助提取青荚叶多酚工艺及抗氧化活性的研究[D].郑州:郑州大学,2014
