摘要
研究目的:在巴西传统医学中,杨桃被用于治疗高血压。本研究旨在评估杨桃水提取物(AEAc)的降压作用及其在离体大鼠胸主动脉中的潜在机制。
材料与方法:通过麻醉大鼠体内实验测定杨桃水提取物AEAc对平均动脉压(MAP)的影响。体外实验中,分离胸主动脉环并悬挂在器官浴中,采用等长张力记录实验方法研究AEAc的作用。通过高效液相色谱(HPLC)分析建立AEAc的指纹色谱图。
结果:在正常血压大鼠中,AEAc(12.5~50.0 mg/kg,静脉注射)引起剂量依赖性降压。体外实验中,AEAc使去甲肾上腺素的最大效应(Emax)反应降低,而敏感性未发生改变。此外,在去极化无钙介质中,杨桃水提取物AEAc抑制CaCl2诱导的收缩,并导致响应曲线浓度依赖性右移,表明AEAc抑制了涉及细胞外钙离子内流的收缩机制。
结论:这些结果证实了杨桃水提取物AEAc的降压作用,其部分效果可能归因于对钙离子的抑制,这支持了其传统应用的相关说法。
1. 引言
长期以来,人们已经认识到血压与心血管风险之间存在直接正相关关系(Whelton等人,2002;Kearney等人,2005)。仅约三分之一的患者通过药物疗法达到理想血压控制(Kearney等人,2005)。由于收缩压降低5 mm Hg与全因死亡率降低7%相关,因此考虑其他能够降低血压的干预措施至关重要(Whelton等人,2002;Chobanian等人,2003)。尽管在高血压的预防、检测、治疗和控制方面取得了进展,但高血压仍然是一个重要的公共卫生问题(Whelton等人,2002;Kearney等人,2005)。一些研究表明,补充与替代医学在高血压治疗中具有潜力(Ernst,2005;Wright等人,2007;Nahas,2008)。此外,过去20年间,补充与替代医学在医生和患者中都得到了越来越多的认可(Nahas,2008)。
草药是全球范围内日益普遍的一种替代疗法形式。Averrhoa carambola L.,即俗称的杨桃,属于漆树科植物,原产于马来西亚,实际上也在包括巴西在内的亚洲各国及美洲热带地区广泛种植,以其独特的星形外观和诱人的风味而闻名。在巴西传统医学中,其果实、果汁或由叶片制成的茶因其被认为具有抗糖尿病和降血压作用而被使用,还被认为具有增进食欲和止泻功效(Oliveira等人,1989;Martha等人,2000;Vicentini等人,2001;Vasconcelos等人,2006)。
在心血管系统方面,由果实制备的杨桃水提取物可降低豚鼠心房收缩力和自律性,提示其具有L型Ca2+通道阻滞作用(Vasconcelos等人,2005),并对正常豚鼠心脏产生电生理变化(Vasconcelos等人,2006)。在本研究中,我们评估了杨桃水提取物在麻醉大鼠中的降压作用。
2. 材料与方法
2.1. 植物材料
于2008年12月(夏季)在巴西米纳斯吉拉斯州阿尔芬纳斯采集了杨桃果实。植物鉴定工作由联邦阿尔芬纳斯大学药学院Dr. Marcelo Polo完成。标本存放在联邦阿尔芬纳斯大学标本馆,编号为HEFOA0190。
2.2. 杨桃水提取物(AEAc)制备
将干燥植物材料(50 g)在去离子水中煮沸20分钟(1 L)。使用Whatman Qualitative Grade-1滤纸过滤去除植物材料,随后进行冻干(得率为4.9%)。在给药前,将粉末新鲜溶解于无菌等渗生理盐水中。对杨桃水提取物的植物化学筛查结果显示含有皂苷、甾醇、单宁和黄酮类化合物。
2.3. 高效液相色谱(HPLC)分析AEAc
使用Shimadzu LC-100 HPLC系统进行AEAc的高效液相色谱分析,配备Shimadzu CLC-ODS(250–4.6 mm)C18柱,粒径为5 μm。流动相由(A)0.5 mM/l水相乙酸和(B)0.1%甲醇中乙酸组成。用于分离的流动相梯度为:0–30 min(10:90)和30–45 min(0:100),流速为1.0 ml/min,波长为333 nm,进样体积为25 μl,浓度为1 mg/ml。采用LC solution软件进行数据收集。通过与标准化合物对比,使用紫外光谱法(190–400 nm)和光电二极管阵列检测器(DAD)确认AEAc中酚类化合物的存在。
2.4. 动物
实验程序遵循联邦阿尔芬纳斯大学伦理审查委员会批准的协议。本研究选用体重250–300 g的雄性Wistar大鼠。动物单独置于塑料笼中,置于12:12小时明暗循环下饲养。除实验期间外,动物可自由饮水并摄取标准实验室饲料。
2.5. 实验方案
2.5.1. AEAc对正常血压大鼠血压影响
实验按照先前描述的方法进行(Xie等人,2007;Gilani等人,2008)。大鼠腹腔注射2,2,2-三溴乙醇(250 mg/kg体重),并在右侧颈外静脉插入硅胶导管以供给予标准药物和植物材料。同时,通过股动脉将聚乙烯导管(PE-10与PE-50熔接,Clay-Adams,美国)插入腹主动脉,用于测量动脉血压(Batista等人,2009)。实验过程中,大鼠持续处于麻醉状态,通过反复给予2,2,2-三溴乙醇维持麻醉。对尾部夹捏无躯体运动反射或对低压力角膜刺激无眨眼反应,被认为是深度麻醉和镇痛的标志。使用与计算机化采集系统(MP100,Biopac,美国)连接的放大器记录平均动脉压(MAP)信号。
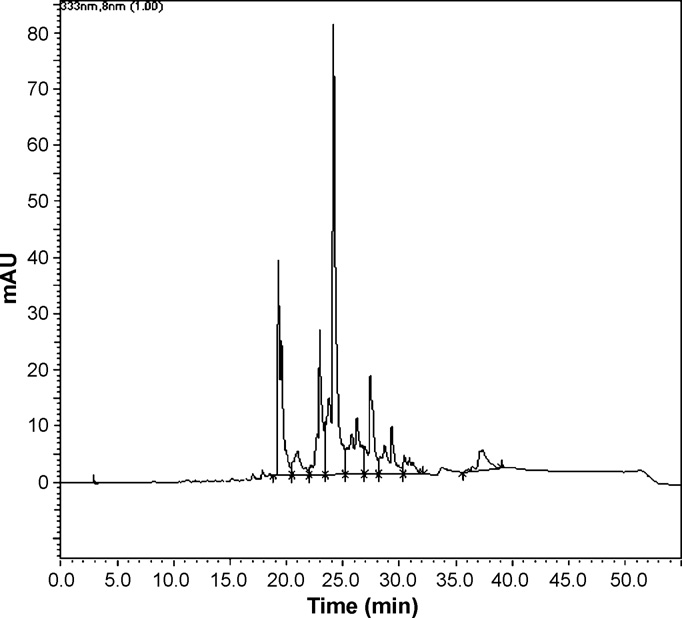
初始血压和心率测量后,大鼠分别静脉注射生理盐水(NaCl 0.9%;1 ml/kg;i.v.)或AEAc(剂量范围为6.25至50.0 mg/kg;i.v.)。在两次注射之间允许动脉血压恢复至静息水平。血压变化被定义为注射前稳态值与注射后最低读数之差(Gilani等人,2008)。
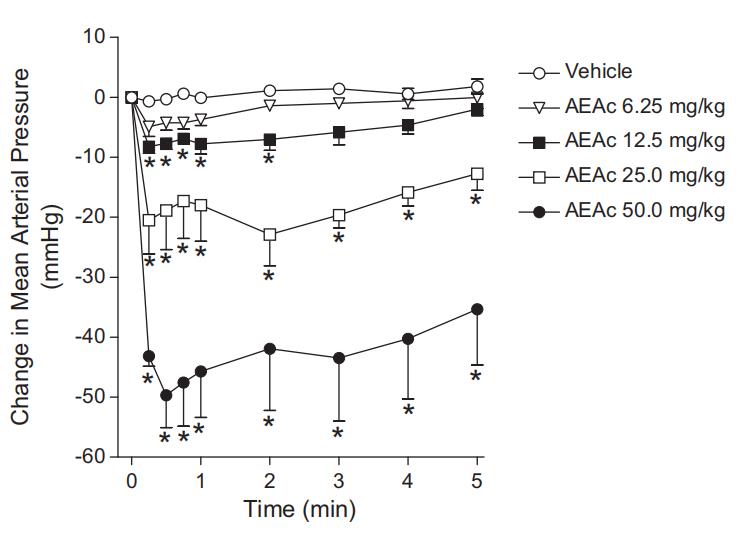
为了探讨AEAc降压反应的机制,另一组实验中,在给予AEAc(50 mg/kg)前,先静脉注射阿托品(1.0 mg/kg)或六甲铵(20 mg/kg)。立即记录MAP。
2.5.2. AEAc对急性高血压大鼠血压的影响
为了评价AEAc对一氧化氮合酶抑制剂诱导急性高血压大鼠血压的影响,动物预先按照先前描述的方法(Pechánová等人,1999)静脉注射Nω-硝基-L-精氨酸甲酯盐酸盐(l-NAME,10 mg/kg)。监测血压,建立急性高血压模型后,大鼠分别静脉注射生理盐水或50 mg/kg提取物,评估提取物的降压效应。
2.5.3. AEAc对去甲肾上腺素或CaCl2诱导的大鼠胸主动脉平滑肌收缩的影响
大鼠通过断头处死,迅速取出胸主动脉,解剖分离并切成3毫米长的环状。主动脉环放置在两根不锈钢支架之间,并连接到与Ugo Basile型号Gemini 7070多道生理记录仪耦合的等张力力传感器上。环状物置于含有以下成分(mmol/l)的10 ml器官浴槽中:130 NaCl,4.7 KCl,1.2 KH2PO4,1.2 MgSO4,14.9 NaHCO3,5.5葡萄糖,2.0 CaCl2。溶液维持pH 7.4,用95% O2和5% CO2气体饱和,温度保持在37℃。环状物首先拉伸至基础张力1.0 g,然后在浴液中平衡。实验在无内皮的情况下进行。通过轻轻滚动血管腔内的细线机械去除内皮,其完整性通过在0.1 μM去甲肾上腺素诱导收缩张力存在时1.0 μM乙酰胆碱引起≥80%的松弛程度进行定性评估。当实验需要去除内皮的主动脉环时,如果观察到一定程度的松弛,则弃去,以避免内皮因素可能的影响。在加入AEAc(1 mg/ml)之前和之后,确定累积浓度-效应曲线对去甲肾上腺素(10^(-9)–10^(-5) M)。两次评估之间,环状物在新鲜缓冲液中孵育1小时,第二次记录响应曲线前30分钟将AEAc添加到浴槽中。
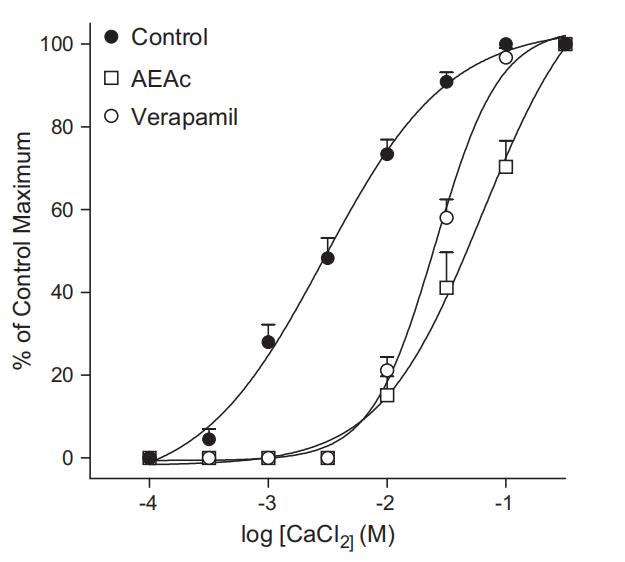
为了评价AEAc的钙拮抗作用,组织在正常Krebs-Henseleit溶液中稳定后,将其替换为无Ca2+的Krebs-Henseleit溶液,孵育30分钟。然后进一步替换为富含K+且无Ca2+的Krebs-Henseleit溶液。经过30分钟的孵育期后,在无AEAc(1 mg/ml)或维拉帕米(1 mM)存在和存在的情况下构建CaCl2的浓度-效应曲线。使用非线性回归分析确定引起最大响应50%的浓度(EC50)。使用EC50值的负对数(pD2)进行统计分析。在涉及高细胞外K+的实验中,通过用KCl等摩尔浓度替代NaCl制备含75 mM KCl的等渗Krebs-Henseleit溶液。
2.6. 药物
硫酸阿托品、六甲铵、Nω-硝基-L-精氨酸甲酯盐酸盐(l-NAME)、去甲肾上腺素和盐酸维拉帕米购自Sigma Chemical Company,美国密苏里州圣路易斯市。所有药物均溶解在无热原等渗生理盐水中。本研究中使用的剂量基于先前的研究(Filep等人,1996;Pechánová等人,1999;Strubelt和Diederich,1999;Giusti-Paiva等人,2004;Medeiros等人,2006;Waki等人,2006;Dhalla等人,2006)。
2.7. 统计分析
所有数据表示为均值±标准误差(SEM)。应用的统计参数为方差分析,后续采用Tukey检验,使用GraphPad程序(GraphPad,美国加利福尼亚州圣地亚哥)进行评估。P值<0.05被认为具有统计学意义。
3. 结果
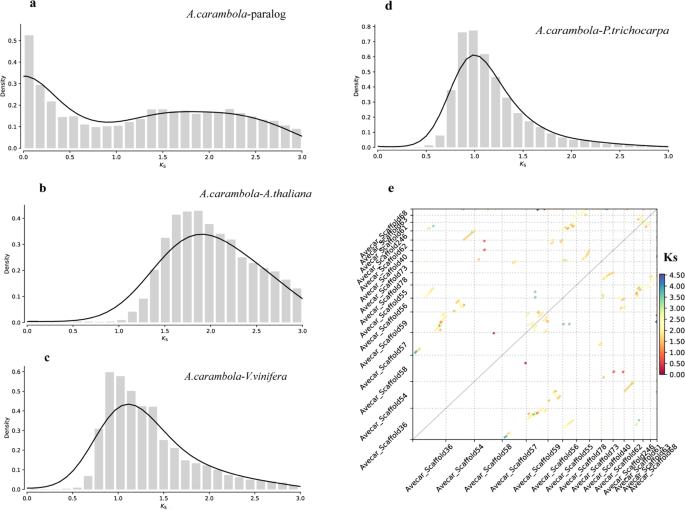
图1展示了杨桃水提取物AEAc在333 nm下的HPLC-DAD分析图谱,主要成分在19.2、19.5、22.9和24.1分钟出现,UV带位于270和337处,被鉴定为黄酮类化合物芹菜素的特征带(Mabry等人,1970)。
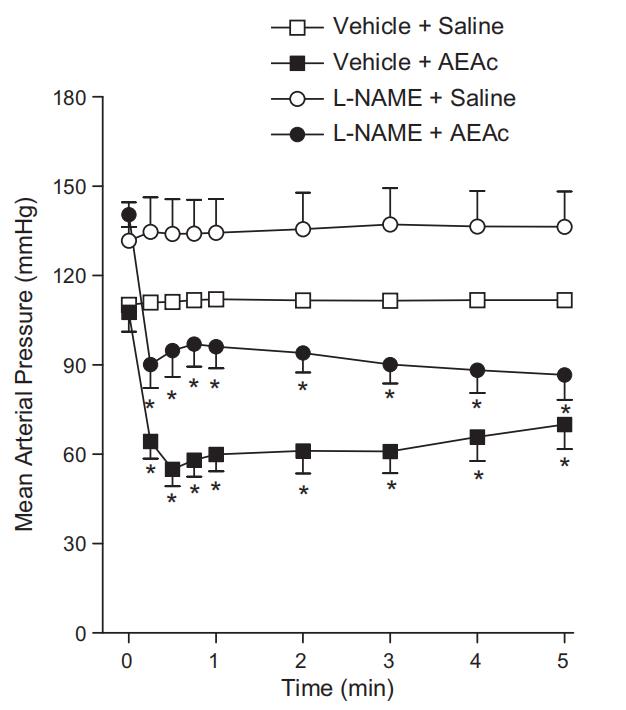
AEAc以剂量依赖方式降低MAP。然而,在降压峰值后,MAP逐渐升高,并在约1–20分钟内恢复到初始基础值,具体时间取决于剂量。静脉注射对照组(0.9%NaCl;1 ml/kg)并未引起血压参数的显著变化(图2)。预先给予硫酸阿托品或六甲铵不影响AEAc(50 mg/kg,i.v.)对麻醉大鼠MAP的降压效应(图3)。
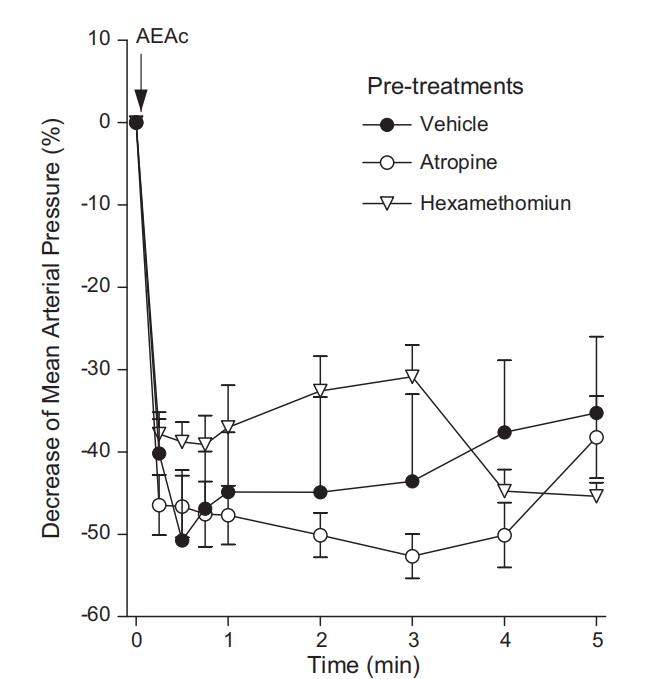
另一组正常血压大鼠给予l-NAME(一氧化氮合酶抑制剂)后,MAP从107.7 ± 6 mm Hg升至134.1 ± 11 mm Hg。预先处理的大鼠静脉注射AEAc(50 mg/kg)后,两组大鼠的平均动脉血压均出现相似程度的降低(图4)。
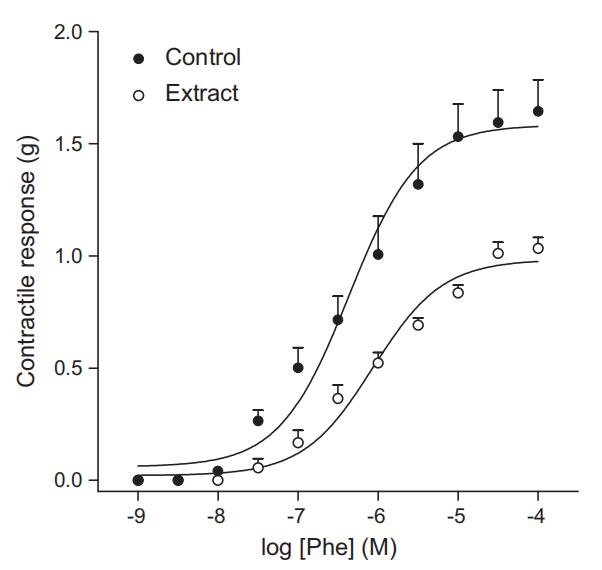
体外实验中,AEAc使去甲肾上腺素引起的Emax反应降低(分别为1.61 ± 0.12 g和1.03 ± 0.05 g,对照组和AEAc组,P = 0.0036),而敏感性(pD2)未发生变化(对照组和AEAc组分别为6.23 ± 0.14和6.01 ± 0.15;图5)。此外,CaCl2在无Ca2+的KCl介质中引起内皮剥离主动脉环的浓度依赖性收缩(pD2 = 2.48 ± 0.09),预先用AEAc或维拉帕米孵育环状物能使CaCl2的浓度-效应曲线右移(AEAc和维拉帕米分别为pD2 = 1.22 ± 0.22和1.51 ± 0.04;图6)。
4. 讨论
本研究证明AEAc在麻醉大鼠中具有降压作用,且这种降压效应不受硫酸阿托品、l-NAME或六甲铵预处理的影响。这些结果表明,毒蕈碱受体、一氧化氮(NO)释放以及作用于血管系统的中枢交感神经驱动并不参与AEAc的降压效应。然而,AEAc的降压作用至少部分是由于Ca2+通道阻滞导致周围血管阻力降低,这一点已在体外得到评估。
众所周知,去甲肾上腺素引起的血管收缩是通过刺激与α-肾上腺素受体偶联的G蛋白介导的(Pérez-Vizcaíno等人,1998),而KCl则通过激活电压依赖性钙通道和随后从肌浆网释放钙来引起平滑肌收缩(Gurney,1994;Ko等人,2008)。因此,这两种收缩剂均通过钙内流显著增加细胞内钙浓度。因此,我们可以推测AEAc的作用是由与钙内流阻断活性相关的非内皮依赖机制介导的。这一解释与Hamilton等人(1987)的发现一致,他们报告称维拉帕米(钙拮抗剂)对α-肾上腺素受体的抑制作用是这些药物在正常血压和高血压兔中引发降压效应的机制。此外,这些结果与Vasconcelos等人(2005)的发现一致,他们报告称杨桃水提取物通过Ca2+通道阻滞降低了豚鼠心房收缩力。
植物提取物通过Ca2+通道阻滞介导的降压或血管舒张作用非常常见。在血管制剂中,已证实植物提取物使Ca2+剂量-效应曲线发生类似于维拉帕米的剂量依赖性右移(Wong等人,2000;Gilani等人,2005、2007、2008)。
对杨桃次生代谢产物特性的研究鉴定了C-糖基黄酮,如芹菜素-6-C-β-L-岩藻糖苷和芹菜素-6-C-(2”-O-L鼠李糖)-β-L-岩藻糖苷(Araho等人,2005)。该化合物也被称为carambolaflavone(Araho等人,2005)。先前报道表明,芹菜素主要通过抑制电压依赖性和受体依赖性钙通道的钙内流来松弛大鼠胸主动脉(Ko等人,2008),其机制与AEAc类似。
总之,本研究结合体内和体外方法,证明杨桃水提取物AEAc能降低正常血压大鼠的动脉血压。AEAc通过与电压依赖性钙通道相互作用,阻断细胞外Ca2+内流。这些效应可能归因于HPLC分析中所揭示的芹菜素的存在。这些结果可能部分解释了杨桃用于治疗高血压等疾病的传统用途。
5.参考文献
1.Araho, D., Masazumi, M.,Wen-hua, C., Toshimitsu, K., Kenji, M., Takao, I., 2005. A new flavones C-glycoside from the leaves of Avehrroa carambola. Natural Medicine 59, 113–116.
2.Batista, M.B., Bravin, A.C., Lopes, L.M., Gerenuti, E., Elias, L.L., Antunes-Rodrigues,J., Giusti-Paiva, A., 2009. Pressor response to fluid resuscitation in endo toxic shock: involvement of vasopressin. Critical Care Medicine 37, 2968–2972.
3.Carolino, R.O., Beleboni, R.O., Pizzo, A.B., Vecchio, F.D., Garcia-Cairasco, N., Moyses Neto, M., Santos, W.F., Coutinho-Netto, J., 2005. Convulsant activity and neurochemical alterations induced by a fraction obtained from fruit Aver rhoa carambola (Oxalidaceae: Geraniales). Neurochemistry International 46,523–531.
4.Chang, J.M., Hwang, S.J., Kuo, H.T., Tsai, J.C., Guh, J.Y., Chen, H.C., Tsai, J.H., Lai, Y.H.,2000.Fatal outcome after ingestion of star fruit (Averrhoa carambola) in uremic patients. American Journal of Kidney Disease 35, 189–193.
5.Chobanian, A.V., Bakris, G.L., Black, H.R., Cushman, W.C., Green, L.A., Izzo Jr., J.L., Jones, D.W., Materson, B.J., Oparil, S., Wright Jr., J.T., Roccella, E.J.,Joint National Committee on Prevention, Detection, Evaluation, and Treat ment of High Blood Pressure. National Heart, Lung, and Blood Institute;National High Blood Pressure Education Program Coordinating Committee,2003.Seventh report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Hypertension 42, 206–1252.
6.Dhalla, A.K., Wong, M.Y., Wang, W.Q., Biaggioni, I., Belardinelli, L., 2006. Tachycardia caused by A2A adenosine receptor agonists is mediated by direct sympathoex citation in awake rats. Journal of Pharmacology and Experimental Therapeutics 316, 695–702.
7.Ernst, E., 2005. Complementary/alternative medicine for hypertension: a mini review. Wiener Medizinische Wochenschrift 155, 386–391.
8.Filep, J.G., Skrobik, Y., Fournier, A., Földes-Filep, E., 1996. Effects of calcium antag onists on endothelin-1-induced myocardial ischaemia and oedema in the rat.British Journal of Pharmacology 118, 893–900.
9.Gilani, A.H., Jabeen, Q., Khan, A.U., Shah, A.J., 2008. Gut modulatory, blood pressure lowering, diuretic and sedative activities of cardamom. Journal of Ethnophar macology 115, 463–472.
10.Gilani, A.H., Khan, A.U., Shah, A.J., Connor, J., Jabeen, Q., 2005. Blood pressure lower ing effect of olive is mediated through calcium channel blockade. International Journal of Food Sciences and Nutrition 56, 613–620.
11.Gilani, A.H., Shah, A.J., Janbaz, K.H., Ahmed, S.P., Ghayur, M.N., 2007. Studies on antihypertensive and antispasmodic activities of Andropogon muricatus Retz.Canadian Journal of Physiology and Pharmacology 85, 911–917.
12.Giusti-Paiva, A., Martinez, M.R., Felix, J.V., da Rocha, M.J., Carnio, E.C., Elias, L.L.,Antunes-Rodrigues, J., 2004. Simvastatin decreases nitric oxide overproduction and reverts the impaired vascular responsiveness induced by endotoxic shock in rats. Shock 21, 271–275.
13.Gurney, A.M., 1994. Mechanisms of drug-induced vasodilation. Journal of Pharmacy and Pharmacology 46, 242–251.
14.Hamilton, C.A., Jardine, E., Sumner, D.J., Reid, J.L., 1987. The effects of calcium antagonists on blood pressure and responses to alpha-adrenoceptor agonists in hypertensive rabbits. Clinical and Experimental Pharmacology and Physiology 14, 77–85.
15.Kearney, P.M., Whelton, M., Reynolds, K., Muntner, P., Whelton, P.K., He, J.,2005.Global burden of hypertension: analysis of worldwide data. Lancet 365,217–223.